题目内容
3.6.02×1023个铝原子有1mol铝原子,有13NA个电子.分析 依据n=$\frac{N}{{N}_{A}}$,1个铝原子含有13个电子,据此计算解答.
解答 解:6.02×1023个铝原子物质的量为:$\frac{6.02×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=1mol,含有电子数目为:1mol×13×NA=13NA;
故答案为:1;13NA;
点评 本题考查了有关物质的量的计算,明确以物质的量为核心的计算公式是解题关键,题目难度不大.

练习册系列答案
相关题目
18.下列有关叙述正确的是( )
| A. | 氢键是一种特殊化学键,它广泛地存在于自然界中 | |
| B. | 在 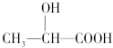 分子中含有1个手性C原子 分子中含有1个手性C原子 | |
| C. | 碘单质在水溶液中溶解度很小是因为I2和H2O都是非极性分子 | |
| D. | 含氧酸可用通式XOm(OH)n来表示,若n值越大,则含氧酸的酸性越大 |
8.下列叙述正确的是( )
| A. | 常温下向水中加入稀氨水,水的电离平衡逆向移动,c(OH-)降低 | |
| B. | 常温下向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 | |
| C. | 常温下向水中加入少量固体CH3COONa,水的电离平衡逆向移动,c(H+)降低 | |
| D. | 常温下将水加热,Kw增大,pH不变 |
15.下列电子式中,正确的是( )
| A. |  | B. |  | C. |  | D. |  |
12.下列有关实验操作设计、现象记录、结论解释都正确的是( )
| 选项 | 实验操作设计 | 现象记录 | 结论解释 |
| A | 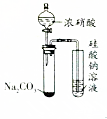 打开分液漏斗 | 右侧试管中出现白色沉淀 | 酸性:HNO3>H2CO3>H2SiO3 |
| B | 向稀硝酸和稀硫酸中分别加入铁粉 | 均有气泡冒出 | 两者均发生氧化还原反应 |
| C | 将SO2通入Ba(NO3)3溶液中 | 有白色沉淀生成 | 白色沉淀是BaSO3 |
| D | 向盛有Fe(NO3)3溶液的试管中加入0.1mol•LH2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO3-被Fe2+ 还原为NO2 |
| A. | A | B. | B | C. | C | D. | D |
13.在醋酸钠溶液中,各离子浓度大小关系正确的是( )
| A. | c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | B. | c(Na+)+c(H+)>c(CH3COO-)+c(OH-) | ||
| C. | c(CH3COO-)>c(Na+)>c(H+)=c(OH-) | D. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
 用系统命名法命名:3,4-二甲基-3-乙基己烷.
用系统命名法命名:3,4-二甲基-3-乙基己烷.
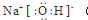 .
.