题目内容
由于NaNO2有毒,将含该物质的废水直接排放会引起水体的严重污染,所以这种废水必须经处理后才能排放.处理方法之一的原理如下:
NaNO2+ KI+ → NO↑+ I2+ K2SO4+ Na2SO4+
(1)请完成并配平该化学方程式.
(2)在上述反应中,若要生成50.8g I2,则电子转移了 个.
(3)用上述反应来处理NaNO2并不是最佳方法,其原因是 .
从环保角度来讲,要处理NaNO2,所用物质的 (填“还原性”或“氧化性”)应该比KI更 (填“强”或“弱”).
(1)请完成并配平该化学方程式.
(2)在上述反应中,若要生成50.8g I2,则电子转移了
(3)用上述反应来处理NaNO2并不是最佳方法,其原因是
从环保角度来讲,要处理NaNO2,所用物质的
考点:氧化还原反应方程式的配平,氧化还原反应的电子转移数目计算
专题:氧化还原反应专题
分析:(1)氧化还原反应中,化合价升高的物质作还原剂,化合价降低的物质作氧化剂,所以NaNO2作氧化剂,KI作还原剂,根据氧化还原反应中得失电子数相等和原子守恒进行配平;
(2)根据反应2NaNO2+2KI+2H2SO4═2NO↑+I2+K2SO4+Na2SO4+2H2O,价态升高的元素只有I,生成1mol碘单质转移电子数为2mol;
(3)一氧化氮是有毒气体,能污染大气;亚硝酸根有毒,从环保角度来讲,要处理NaNO2,所用的物质的还原性比KI更强,使其N元素化合价由+3价变为无污染的0价氮.
(2)根据反应2NaNO2+2KI+2H2SO4═2NO↑+I2+K2SO4+Na2SO4+2H2O,价态升高的元素只有I,生成1mol碘单质转移电子数为2mol;
(3)一氧化氮是有毒气体,能污染大气;亚硝酸根有毒,从环保角度来讲,要处理NaNO2,所用的物质的还原性比KI更强,使其N元素化合价由+3价变为无污染的0价氮.
解答:
解:(1)该反应中元素的化合价变化如下:2KI→I2,I元素的化合价由-1价→0价,I失去2e-;NaNO2→NO,N元素的化合价由+3价→+2价,得到e-,化合价升高数=化合价降低数,所以得失电子的最小公倍数为2,所以NaNO2前的系数是2,I2前的系数是1,根据钠、钾原子守恒,K2SO4前是1,Na2SO4前是1,根据硫酸根守恒,反应物少2个H2SO4分子,据氧原子和氢原子守恒,产物水前的系数为2,所以该反应为:2NaNO2+2KI+2H2SO4═2NO↑+I2+K2SO4+Na2SO4+2H2O;
故答案为:2;2;2H2SO4;2;1;1;1;2H2O;
(2)根据2KI→I2,每生成1molI2,转移2mol电子,50.8g碘单质的物质的量n=
=
=0.2mol,所以转移电子数=nNA=0.2×2NA=0.4NA;
故答案为:0.4NA;
(3)一氧化氮是有毒气体,能污染大气,该反应中生成了一氧化氮,所以会造成大气污染;亚硝酸根有毒,从环保角度来讲,要处理NaNO2,所用的物质的还原性比KI更强,使其N元素化合价由+3价变为无污染的0价氮,如NaNO2+NH4Cl=NaCl+N2↑+2H2O,
故答案为:反应生成了NO,该物质会造成大气污染;还原性;强.
故答案为:2;2;2H2SO4;2;1;1;1;2H2O;
(2)根据2KI→I2,每生成1molI2,转移2mol电子,50.8g碘单质的物质的量n=
| m |
| M |
| 50.8g |
| 254g/mol |
故答案为:0.4NA;
(3)一氧化氮是有毒气体,能污染大气,该反应中生成了一氧化氮,所以会造成大气污染;亚硝酸根有毒,从环保角度来讲,要处理NaNO2,所用的物质的还原性比KI更强,使其N元素化合价由+3价变为无污染的0价氮,如NaNO2+NH4Cl=NaCl+N2↑+2H2O,
故答案为:反应生成了NO,该物质会造成大气污染;还原性;强.
点评:本题以NaNO2为载体考查氧化还原反应以及物质的检验等知识,根据亚硝酸盐中氮元素的化合价分析其性质,注意把握题给信息,为解答该题的关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
类推是中学化学学习中一种重要的思维方法.下列类推结论正确的是( )
| A、CO2能使苯酚钠溶液变浑浊,稀HCl也能使苯酚钠溶液变浑浊 |
| B、NH4HCO3溶液呈碱性,NH4HSO4溶液也呈碱性 |
| C、CaCO3与稀硝酸反应生成CO2,CaSO3与稀硝酸反应生成SO2 |
| D、常温下,Al在浓硫酸中无明显变化,Mg在浓硫酸中也无明显变化 |
下列实验方案与现象能说明溶液中一定大量存在相应离子的是( )
A、NH4+:试液
| |||||
B、I-:试液
| |||||
C、HCO3-:试液
| |||||
D、Fe2+:试液
|
下列物质中既能与盐酸反应又能与NaOH溶液反应的是( )
①Al2O3 ②Al(OH)3 ③NH4NO3 ④Na2CO3 ⑤NaHCO3 ⑥(NH4)2CO3 ⑦MgO ⑧Mg(OH)2.
①Al2O3 ②Al(OH)3 ③NH4NO3 ④Na2CO3 ⑤NaHCO3 ⑥(NH4)2CO3 ⑦MgO ⑧Mg(OH)2.
| A、①②⑦⑧ | B、①②④⑤ |
| C、①②⑤⑥ | D、③⑥⑦⑧ |
已知:4NH3+5O2=4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)(mol/(L?s))表示,则正确的关系是( )
A、v(O2)=
| ||
B、v(H2O)=
| ||
C、v(H2O)=
| ||
D、v(NO)=
|
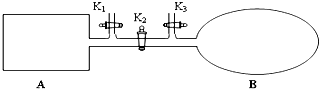 如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,将各1mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L.
如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,将各1mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L.