题目内容
有关氨气的制取和性质实验如图.

(1)实验前若要检验装置A的气密性,其操作是 .
(2)装置B中盛放的试剂是 .
(3)装置C中的反应产物均为无污染,写出化学方程式: .
(4)尾气吸收装置D可以是下列装置中的

(5)装置E的作用是 .
(6)装置F中反应现象是 ,此时关闭弹簧夹2,产生的现象是 .
(7)反应前后装置C中固体质量分别为16.0g和13.6g,则CuO的纯度为 (设CuO完全反应)

(1)实验前若要检验装置A的气密性,其操作是
(2)装置B中盛放的试剂是
(3)装置C中的反应产物均为无污染,写出化学方程式:
(4)尾气吸收装置D可以是下列装置中的

(5)装置E的作用是
(6)装置F中反应现象是
(7)反应前后装置C中固体质量分别为16.0g和13.6g,则CuO的纯度为
考点:氨的制取和性质
专题:
分析:(1)组装好装置后,若要检验A装置的气密性,其操作是:首先关闭弹簧夹1、2和分液漏斗活塞,打开玻璃塞,向分液漏斗中装入一定量的水后,打开活塞,水滴下一段时间后不能继续滴下,证明装置A气密性良好;
(2)进入C中硬质试管的氨气应干燥,装置B的作用是干燥氨气,干燥氨气用碱石灰;
(3)装置C中的反应产物均为无污染,说明氨气被氧化为氮气,同时生成水;
(4)吸收尾气时,导管伸入吸收液中,对于HCl、NH3等易溶于水的气体,易发生倒吸,为了防止倒吸,可以在导管中连接体积较大的容器;
(5)根据E装置防止左侧装置中溶液倒吸到反应装置A中进行分析;
(6)常温下氨跟氯气能发生置换反应,方程式为:2NH3+3Cl2=N2+6HCl,氯化氢和氨气相遇生成氯化铵固体,反应方程式为NH3+HCl=NH4Cl,有白烟;关闭弹簧夹2,装置G中溶液要发生倒吸现象;
(7)根据反应2NH3+3CuO
3Cu+N2↑+3H2O,利用差量法求出CuO的质量,然后求出CuO的纯度.
(2)进入C中硬质试管的氨气应干燥,装置B的作用是干燥氨气,干燥氨气用碱石灰;
(3)装置C中的反应产物均为无污染,说明氨气被氧化为氮气,同时生成水;
(4)吸收尾气时,导管伸入吸收液中,对于HCl、NH3等易溶于水的气体,易发生倒吸,为了防止倒吸,可以在导管中连接体积较大的容器;
(5)根据E装置防止左侧装置中溶液倒吸到反应装置A中进行分析;
(6)常温下氨跟氯气能发生置换反应,方程式为:2NH3+3Cl2=N2+6HCl,氯化氢和氨气相遇生成氯化铵固体,反应方程式为NH3+HCl=NH4Cl,有白烟;关闭弹簧夹2,装置G中溶液要发生倒吸现象;
(7)根据反应2NH3+3CuO
| ||
解答:
解:(1)组装好装置后,若要检验A装置的气密性,其操作是:首先关闭弹簧夹1、2和分液漏斗活塞,打开玻璃塞,向分液漏斗中装入一定量的水后,打开活塞,水滴下一段时间后不能继续滴下,证明装置A气密性良好;
故答案为:关闭弹簧夹1、2和分液漏斗活塞,打开玻璃塞,向分液漏斗中装入一定量的水后,打开活塞,水滴下一段时间后不能继续滴下,证明装置A气密性良好;
(2)进入C中硬质试管的氨气应干燥,装置B的作用是干燥氨气,干燥氨气用碱石灰,
故答案为:碱石灰;
(3)装置C中的反应产物均为无污染,说明氨气被氧化为氮气,同时生成水,C中发生反应的化学方程式为:2NH3+3CuO
3Cu+N2↑+3H2O;
故答案为:2NH3+3CuO
3Cu+N2↑+3H2O;
(4)a.连接的漏斗伸入吸收液中,不能防止倒吸,故a错误;
b.该装置连接了体积较大的容器,既能防止倒吸,又能很好的吸收尾气,故b正确;
c.导管伸入吸收液中,不能防止倒吸,故c错误;
d.该装置连接了体积较大的容器,既能防止倒吸,又能很好的吸收尾气,故d正确;
e.导管伸入吸收液中,不能防止倒吸,故e错误;
故选:bd;
(5)E装置防止左侧装置中溶液倒吸到反应装置A中,所以E起到了安全瓶的作用,故答案为:安全瓶;
(6)常温下氨跟氯气能发生置换反应,方程式为:2NH3+3Cl2=N2+6HCl,氯化氢和氨气相遇生成氯化铵固体,反应方程式为NH3+HCl=NH4Cl,有白烟;关闭弹簧夹2,装置G中溶液要发生倒吸现象;
故答案为:产生白烟;G中溶液要倒吸入F;
(7)设参加反应的氧化铜的质量为xg,则
2NH3+3CuO
3Cu+N2↑+3H2O△m
240 192 48
xg 16.0g-13.6g
解得x=12,所以CuO的纯度=
×100%=75%;
故答案为:75%.
故答案为:关闭弹簧夹1、2和分液漏斗活塞,打开玻璃塞,向分液漏斗中装入一定量的水后,打开活塞,水滴下一段时间后不能继续滴下,证明装置A气密性良好;
(2)进入C中硬质试管的氨气应干燥,装置B的作用是干燥氨气,干燥氨气用碱石灰,
故答案为:碱石灰;
(3)装置C中的反应产物均为无污染,说明氨气被氧化为氮气,同时生成水,C中发生反应的化学方程式为:2NH3+3CuO
| ||
故答案为:2NH3+3CuO
| ||
(4)a.连接的漏斗伸入吸收液中,不能防止倒吸,故a错误;
b.该装置连接了体积较大的容器,既能防止倒吸,又能很好的吸收尾气,故b正确;
c.导管伸入吸收液中,不能防止倒吸,故c错误;
d.该装置连接了体积较大的容器,既能防止倒吸,又能很好的吸收尾气,故d正确;
e.导管伸入吸收液中,不能防止倒吸,故e错误;
故选:bd;
(5)E装置防止左侧装置中溶液倒吸到反应装置A中,所以E起到了安全瓶的作用,故答案为:安全瓶;
(6)常温下氨跟氯气能发生置换反应,方程式为:2NH3+3Cl2=N2+6HCl,氯化氢和氨气相遇生成氯化铵固体,反应方程式为NH3+HCl=NH4Cl,有白烟;关闭弹簧夹2,装置G中溶液要发生倒吸现象;
故答案为:产生白烟;G中溶液要倒吸入F;
(7)设参加反应的氧化铜的质量为xg,则
2NH3+3CuO
| ||
240 192 48
xg 16.0g-13.6g
解得x=12,所以CuO的纯度=
| 12g |
| 16g |
故答案为:75%.
点评:本题考查氨气的制备与性质实验、对装置的理解、实验操作、化学计算,难度中等,掌握物质的性质、理解原理是解题的关键,是对知识的综合考查,需要学生具有扎实的基础与分析问题、解决问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是( )
| A、常温下,反应4Na(s)+O2(g)═2Na2O(s)的△H<0,△S>0 | |||
| B、反应2A(g)+B(g)═3C(s)+D(g)在一定条件下能自发进行,说明该反应的△H<0 | |||
| C、合成氨生产中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 | |||
D、反应2SO2+O2
|
几种短周期元素的原子半径及主要化合价如下表:下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A、X元素在周期表中的位置是第三周期第Ⅱ族 |
| B、X和W能形成离子化合物 |
| C、Y的最高价氧化物对应的水化物能溶于稀氨水 |
| D、Z的氢化物的稳定性比W的氢化物的稳定性弱 |
“绿色化学”提倡化工生产应尽可能将反应物的原子全部利用,从根本上解决环境污染问题.在下列制备环氧乙烷的反应中,最符合“绿色化学”思想的是( )
A、 |
| B、CH2=CH2+Cl2+Ca(OH)2→CH2-CH2+CaCl2+H2O |
C、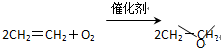 |
D、 |
下列说法正确的是( )
| A、用高锰酸钾溶液滴定Na2SO3溶液至终点:滴入最后一滴高锰酸钾溶液,溶液恰好由紫色变为无色,且半分钟不变色 |
| B、通常用产生气泡的快慢,比较不同条件下Na2S2O3溶液与稀硫酸反应速率 |
| C、润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从下口放出,重复2~3次 |
| D、制备硫酸亚铁晶体时,最后在蒸发皿中蒸发浓缩溶液时,只需小火加热至溶液被全部蒸干 |
下列化学用语中,正确的是( )
A、氯化钠的电子式为? |
B、Mg2+的结构示意图: |
C、氯化氢分子的形成过程可用电子式表示为: |
D、N2的电子式: |

 50mL 0.50mol?L-1的盐酸与50mL 0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热,完成下列问题:
50mL 0.50mol?L-1的盐酸与50mL 0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热,完成下列问题:
