题目内容
1.下列递变情况正确的是( )| A. | Na、Mg、Al最外层电子数依次增多,其还原性依次增强 | |
| B. | P、S、Cl最高正价依次升高,对应气态氢化物稳定性依次增强 | |
| C. | C、N、O原子半径依次增大 | |
| D. | Na和K属于第ⅠA族元素,其氧化物的水化物碱性:NaOH比KOH强 |
分析 A.同周期自左到右金属性逐渐减弱,金属单质的还原性减弱;
B.P、S、Cl的最高正化合价=最外层电子数,同周期自左到右非金属性逐渐增强,对应气态氢化物越稳定;
C.同周期元素自左向右,原子半径依次减小;
D.同主族元素自上而下金属性逐渐增强,金属性越强,最高价氧化物对应水化物的碱性越强.
解答 解:A.Na、Mg、Al最外层电子数依次增多,其还原性依次减弱,故A错误;
B.P、S、Cl的最外层电子数分别为5、6、7,最高正价分别为+5、+6、+7,非金属性依次增强,对应气态氢化物稳定性依次增强,故B正确;
C.同周期元素自左向右,原子半径依次减小,因此C、N、O原子半径依次减小,故C错误;
D.金属性K>Na,最高价氧化物对应水化物的碱性KOH>NaOH,故D错误;
故选B.
点评 本题考查元素周期律的应用,为高频考点,明确同周期元素自左向右最外层电子数逐渐增多,最高正价逐渐升高,原子半径逐渐增大,金属性逐渐减弱,非金属性逐渐增强.同主族元素自上而下金属性逐渐增强是答题关键,题目难度不大.

练习册系列答案
相关题目
7.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 10℃时,1LpH=1.0的H2SO4溶液中含H+为0.1NA | |
| B. | 常温下,14g的146C含中子数目为6NA | |
| C. | 标况下,11.2LNO与11.2LO2混合,原子总数小于2NA | |
| D. | 0.1mol苯乙烯含碳碳双键为0.4NA |
9.下列关于反应H2(g)+I2(g)?2HI(g)的平衡常数K的说法中,正确的是( )
| A. | 在任何条件下,化学平衡常数是一个恒定量 | |
| B. | 改变反应物浓度或生成物浓度都会改变平衡常数K | |
| C. | 从平衡常数K的大小不能推断一个反应进行的程度 | |
| D. | 平衡常数K只与温度有关,与反应物的浓度无关 |
16.下列有关物质用途的说法正确的是( )
| A. | 氯气可用于自来水消毒 | B. | 甲醛可用作食品防腐剂 | ||
| C. | 碳酸钠可用来治疗胃酸过多 | D. | 铝制容器可长期存放碱性物质 |
6.下列关于某无色溶液所含离子检验的方法和结论正确的是( )
| A. | 加入NaOH溶液产生红褐色沉淀,则原溶液中一定有FeCl3 | |
| B. | 加入盐酸产生能使澄清石灰水变浑浊的气体,则原溶液中一定是CO32-或SO32- | |
| C. | 先通入少量Cl2后,再加入淀粉溶液后,溶液变蓝,说明有I- | |
| D. | 往溶液中加入BaCl2溶液和稀HNO3,有白色沉淀生成,说明一定有SO42- |
10.用石墨棒作阳极、铁棒作阴极电解熔融的氯化钠,下列说法中正确的是( )
| A. | 石墨周围有大量的Na+ | |
| B. | 铁棒质量增加 | |
| C. | 电子通过电解质溶液由石墨棒流向铁棒 | |
| D. | 铁棒电极发生氧化反应 |
11.对比甲烷和乙烯的燃烧反应,下列叙述中正确的是( )
| A. | 二者燃烧时现象完全相同 | |
| B. | 点燃前都不需要验纯 | |
| C. | 甲烷燃烧火焰呈淡蓝色,乙烯燃烧火焰较明亮 | |
| D. | 二者燃烧时都有黑烟生成 |
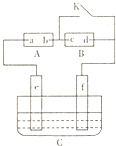 如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
 ;其反应类型是消去反应.
;其反应类型是消去反应.