题目内容
12.下列化学用语表示正确的是( )| A. | OH-的电子式: | |
| B. | F-的结构示意图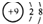 | |
| C. | N2的结构式: | |
| D. | 碳酸氢钠的电离方程式:NaHCO3=Na++H++CO32- |
分析 A、氢氧根是阴离子,应用[]将最外层电子括起来;
B、F-是氟原子得一个电子得到的;
C、氮气中氮原子间为三键;
D、碳酸氢钠为强电解质,完全电离,注意碳酸氢根离子为弱酸的酸式根离子不能拆.
解答 解:A、氢氧根是阴离子,应用[]将最外层电子括起来,故OH-电子式为: ,故A错误;
,故A错误;
B、F-是氟原子得一个电子得到的,故氟离子的核电荷数为9,但核外有10个电子,故结构示意图为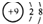 ,故B正确;
,故B正确;
C、氮气分子中存在氮氮三键,氮气的结构式为:N≡N,故C错误;
D、碳酸氢钠为强电解质,完全电离,但碳酸氢根是弱酸根,不能完全电离,故电离方程式:NaHCO3═Na++HCO3-,故D错误.
故选B.
点评 本题考查了常见的化学用语的使用,难度不大,应注意氢氧根和羟基的电子式的书写的区别和碳酸氢钠的电离方程式的书写.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
17.某学生的实验报告所列出的下列数据中合理的是 ( )(填写序号).
| A. | 用托盘天平称量25.20g NaCl | |
| B. | 用10mL量筒量取7.1mL稀盐酸 | |
| C. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| D. | 用浓度分别为0.50mol/L,体积各为50mL盐酸、氢氧化钠溶液测定中和热 |
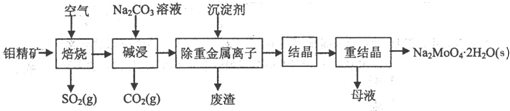
4.光谱研究表明,过硫化氢溶于水时形成某一浓度的溶液中存在着下列平衡和反应:

下列判断中正确的是( )

下列判断中正确的是( )
| A. | 该溶液中存在H2S分子 | |
| B. | 该溶液中H+的浓度是S${\;}_{2}^{2-}$浓度的2倍 | |
| C. | 向该溶液中加入足量的硝酸能产生H2S气体 | |
| D. | 向该溶液中加入过量的NaOH溶液可得到含大量NaHS2的混合溶液 |
12.下列关于热化学反应的描述中正确的是( )
| A. | CO(g)的燃烧热是283.0 kJ/mol,则表示CO燃烧热的热化学方程式为2CO(g)+O2(g)═2CO2(g);△H=-566.0 kJ/mol | |
| B. | 由石墨比金刚石稳定可知:C(金刚石,s)=C(石墨,s);△H<0 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 已知:2SO2 (g)+O2(g)?2SO3 (g);△H=-98.3 kJ/mol.将1 mol SO2和0.5 mol O2充入一密闭容器中反应,放出49.15 kJ的热量 |
13.水杨酸是重要的精细化工原料,它的结构简式如图.则水杨酸的芳香族同分异构体( )
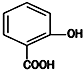

| A. | 可能含有两个醛基 | B. | 可能含有三个羟基 | ||
| C. | 都能与氢氧化钠溶液反应 | D. | 分子式都是C7H6O3 |