题目内容
2.下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用元素符号、离子符号或化学式回答下列问题: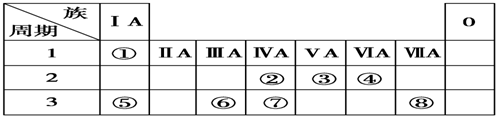
(1)④、⑥、⑧的原子半径由大到小的顺序是:(请用>、<表示)r(Al)>r(o)>r(Cl).
(2)②、③、⑧的最高价含氧酸的酸性由强到弱的顺序是:HClO4>HNO3>H2CO3.
(3)请写出由②、④、⑦三种元素的氢化物稳定性由弱到强的顺序是:SiH4<CH4<H2O.
(4)⑤、⑥两种元素的最高价氧化物对应的水化物在溶液中相互反应的离子方程式是:Al(OH)3+OH-=[Al(OH)4]-.
(5)由表中两种元素的原子按1:1组成的一种常见液态化合物的稀溶液易被
催化分解,可使用的催化剂为(填序号)b.
a.KMnO4b.MnO2c.Na2SO3.
分析 根据元素所在周期表中的位置,可知元素的种类,①为H元素,②为C元素,③为N元素,④为O元素,⑤为Na元素,⑥为Al元素,⑦为Si元素,⑧为Cl元素,
(1)周期表中,同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大;
(2)元素的非金属性越强,对应的最高价含氧酸的酸性越强;
(3)同周期从左到右非金属性逐渐增强,同主族自上而下非金属性逐渐减弱,非金属性越强氢化物越稳定;
(4)⑤、⑥两种元素的最高价氧化物对应的水化物分别为NaOH、氢氧化铝,二者反应生成偏铝酸钠与水;
(5)两种元素的原子按1:1组成的常见液态化合物为双氧水.
解答 解:根据元素所在周期表中的位置,可知元素的种类,①为H元素,②为C元素,③为N元素,④为O元素,⑤为Na元素,⑥为Al元素,⑦为Si元素,⑧为Cl元素,
(1)Cl与Al同周期,周期表中,同周期元素从左到右原子半径逐渐减小,则原子半径Al>Cl,原子核外电子层数越多,半径越大,则有原子半径Al>Cl>O,
故答案为:r(Al)>r(o)>r(Cl);
(2)②、③、⑧对应的元素分别为C、N、Cl,非金属性:Cl>N>C,元素的非金属性越强,对应的最高价含氧酸的酸性越强,则HClO4>HNO3>H2CO3,
故答案为:HClO4>HNO3>H2CO3;
(3)②、④、⑦三种元素的非金属性O>C>Si,非金属性越强氢化物越稳定,所以三种元素的氢化物由弱到强的顺序是SiH4<CH4<H2O,故答案为:SiH4<CH4<H2O;
(4)⑤、⑥两种元素的最高价氧化物对应的水化物分别为NaOH、氢氧化铝,二者反应生成偏铝酸钠与水;反应离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O.
(5)两种元素的原子按1:1组成的常见液态化合物为H2O2,在MnO2或FeCl3催化作用下分解,而Na2SO3具有还原性,与H2O2发生氧化还原反应,不能用作催化剂,高锰酸钾具有强氧化性,与H2O2发生氧化还原反应,也不能作催化剂,
故答案为:b.
点评 本题考查元素的推断,题目难度不大,根据元素在周期表中的位置可推断出元素的种类,题中侧重于周期律的应用,学习中注意积累相关知识,把握正确的解题思路.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案| A. | 氯水中:c(Cl2)═2[c(ClO-)+c(Cl-)+C(HClO)] | |
| B. | 氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) | |
| C. | 等体积等浓度的氢氧化钠与醋酸混合:c(Na+)>c(CH3COO-) | |
| D. | Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) |
| A. | 铁溶于稀硝酸中:Fe+2H+=Fe2++H2↑ | |
| B. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O | |
| C. | 少量CO2通入苯酚钠溶液中:2C6H5O-+CO2+H2O=2C6H5OH+CO32- | |
| D. | 大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
| A. | 硫化钠水解 S2-+2H2O?H2S+2OH- | |
| B. | 硫氢化钠的水解 HS-+H2O?H3O++S2- | |
| C. | 制Fe(OH)3胶体 Fe3++3H2O?Fe(OH)3↓+3H+ | |
| D. | 硫酸铝溶液跟偏铝酸钠溶液反应 Al3++3AlO2-+6H2O═4Al(OH)3↓ |
| A. | 硫酸钡难溶于水,但硫酸钡属于强电解质 | |
| B. | 强电解质都是可溶性化合物,弱电解质都是难溶性化合物 | |
| C. | 氯化氢水溶液能导电,所以氯化氢是电解质 | |
| D. | 强电解质能够电离,弱电解质不能电离 |
| A. | Ba(OH)2溶液中加入过量Al2(SO4)3溶液:3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓ | |
| B. | FeCl3溶液中加少量Na2S溶液:2Fe3++S2-=2Fe2++S↓ | |
| C. | 向硫酸铜溶液中加入过量氨水:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+ | |
| D. | 向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2++2HCO3-+2OH-=CO32-+CaCO3↓+2H2O |
| A. | OH-的电子式: | |
| B. | F-的结构示意图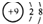 | |
| C. | N2的结构式: | |
| D. | 碳酸氢钠的电离方程式:NaHCO3=Na++H++CO32- |
 X,Y,Z,R,W均为周期表中前四周期的元素,其原子序数依次增大;x2-和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质.回答下列间题(相关回答均用元素符号表示):
X,Y,Z,R,W均为周期表中前四周期的元素,其原子序数依次增大;x2-和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质.回答下列间题(相关回答均用元素符号表示):