题目内容
中和热的测定实验的关键是要比较准确地配制一定的物质的量浓度的溶液,量热器要尽量做到绝热;在量热的过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化.回答下列问题:
(1)中学化学实验中的中和热的测定所需的玻璃仪器有: ,在大小烧杯之间填满碎泡沫(或纸条)其作用是 .
(2)该实验可用0.60mol?L-1HCl和0.65mol?L-1的NaOH溶液各50mL.NaOH的浓度大于HCl的浓度作用是 .当室温低于10℃时进行,对实验结果会造成较大的误差其原因是 .
(3)若上述HCl、NaOH溶液的密度都近似为1g/cm3,中和后生成的溶液的比热容C=4.18J/(g?℃),实验进行了三次,三次实验的△T平均为3.30℃,则该中和反应放出热量为 kJ(填表达式),△H= kJ/mol(填表达式).
(1)中学化学实验中的中和热的测定所需的玻璃仪器有:
(2)该实验可用0.60mol?L-1HCl和0.65mol?L-1的NaOH溶液各50mL.NaOH的浓度大于HCl的浓度作用是
(3)若上述HCl、NaOH溶液的密度都近似为1g/cm3,中和后生成的溶液的比热容C=4.18J/(g?℃),实验进行了三次,三次实验的△T平均为3.30℃,则该中和反应放出热量为
考点:中和热的测定
专题:实验题
分析:(1)根据量热计的构造和实验步骤来确定实验的仪器;中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎泡沫塑料的作用是:保温、隔热、减少实验过程中的热量散失;
(2)为了保证HCl完全反应,碱应过量;温度过低,散热加快,对实验结过造成的误差较大;
(3)先根据Q=m?c?△T计算反应放出的热量,然后根据△H=-
kJ/mol计算出反应热.
(2)为了保证HCl完全反应,碱应过量;温度过低,散热加快,对实验结过造成的误差较大;
(3)先根据Q=m?c?△T计算反应放出的热量,然后根据△H=-
| Q |
| n |
解答:
解:(1)中和热测定的实验中,用到的玻璃仪器有大烧杯、小烧杯、温度计、量筒、胶头滴管,环形玻璃搅拌棒;大小烧杯之间填满碎泡沫塑料的作用是:保温、隔热、减少实验过程中的热量散失,
故答案为:大烧杯、小烧杯、温度计、量筒、胶头滴管,环形玻璃搅拌棒;保温、隔热、减少实验过程中热量的损失;
(2)NaOH的浓度大于HCl的浓度,使盐酸完全被中和,减少了盐酸挥发对实验的影响;如果温度过低,散热加快,对实验结过造成的误差较大,
故答案为:保证盐酸完全被中和;散热太快;
(3)0.60mol?L-1HCl和0.65mol?L-1的NaOH溶液各50mL进行中和反应,生成水的物质的量为0.05L×0.60mol?L-1=0.03mol,溶液的质量为:100ml×1g/ml=100g,温度变化的值△T为3.30℃来计算,则生成0.03mol水放出的热量为Q=m?c?△T=100g×4.18J/(g?℃)×3.30℃=100×4.18×3.3×10-3kJ,所以实验测得的中和热△H=-
kJ/mol,
故答案为:100×4.18×3.3×10-3;-
.
故答案为:大烧杯、小烧杯、温度计、量筒、胶头滴管,环形玻璃搅拌棒;保温、隔热、减少实验过程中热量的损失;
(2)NaOH的浓度大于HCl的浓度,使盐酸完全被中和,减少了盐酸挥发对实验的影响;如果温度过低,散热加快,对实验结过造成的误差较大,
故答案为:保证盐酸完全被中和;散热太快;
(3)0.60mol?L-1HCl和0.65mol?L-1的NaOH溶液各50mL进行中和反应,生成水的物质的量为0.05L×0.60mol?L-1=0.03mol,溶液的质量为:100ml×1g/ml=100g,温度变化的值△T为3.30℃来计算,则生成0.03mol水放出的热量为Q=m?c?△T=100g×4.18J/(g?℃)×3.30℃=100×4.18×3.3×10-3kJ,所以实验测得的中和热△H=-
| 100×4.18×3.3×10-3 |
| 0.03 |
故答案为:100×4.18×3.3×10-3;-
| 100×4.18×3.3×10-3 |
| 0.03 |
点评:本题考查中和热的测定与计算,题目难度中等,注意理解中和热的概念是解题的关键.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
下列有关溶液中粒子浓度的关系式中,正确的是( )
| A、pH相同的①CH3COONa、②NaHCO3、③Na2CO3三份溶液中的c(Na+):③>②>① |
| B、0.1mol?L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A) |
C、如图中pH=7时:c(Na+)>c(CH3COO-)>c(OH-)=c(H+) |
D、如图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
下列离子在强酸性溶液中能大量共存的是( )
| A、Cl-、ClO-、Fe2+、K+ |
| B、NH4+、SO42-、K+、Cl- |
| C、MnO4-、Cl-、Na+、K+ |
| D、HCO3-、SO42-、K+、Mg2+ |
下列离子方程式正确的是( )
| A、铁与稀硫酸反应:Fe+6H+=2Fe3++3H2↑ |
| B、用稀盐酸除铁锈:Fe2O3+6H+=2Fe3++3H2O |
| C、碳酸钙与稀盐酸反应:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D、氢氧化钡溶液与硫酸溶液反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
下列离子方程式书写正确的是( )
| A、单质铜与稀硝酸反应3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O |
| B、钠与水的反应Na+2H2O=Na++2OH-+H2↑ |
| C、氯气溶于水Cl2+H2O=2H++ClO-+Cl- |
| D、碳酸氢钠跟盐酸反应CO32-+2H+=H2O+CO2 |
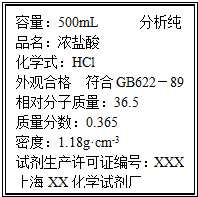 取质量为14.8g的Na2CO3和NaHCO3的固体混合物,与100mL 2.50mol?L-1的盐酸恰好完全反应不再放出气体.
取质量为14.8g的Na2CO3和NaHCO3的固体混合物,与100mL 2.50mol?L-1的盐酸恰好完全反应不再放出气体.