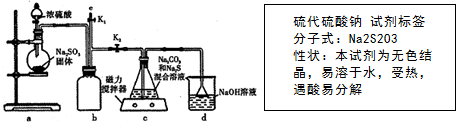
题目内容
5.使1mol某烷烃完全燃烧需要消耗氧气5mol,该烷烃的化学式是( )| A. | C2H6 | B. | C3H8 | C. | C4H10 | D. | C5H12 |
分析 设烷烃的分子式为CnH2n+2,根据烷烃通式为CnH2n+2+$\frac{3n+1}{2}$O2$\stackrel{点燃}{→}$nCO2+(n+1)H2O确定烷烃的分子式.
解答 解:设烷烃的分子式为CnH2n+2,根据烷烃通式为CnH2n+2+$\frac{3n+1}{2}$O2$\stackrel{点燃}{→}$nCO2+(n+1)H2O,
1 $\frac{3n+1}{2}$
1 5
n=3,该烷烃的分子式为C3H8,
故选B.
点评 本题考查有机物分子式的确定,侧重于学生的计算能力的考查,难度不大,注意根据烷烃燃烧的通式进行计算.

练习册系列答案
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案
相关题目
16.0.1mol•L-1的盐酸溶液与0.1mol•L-1的氨水等体积混合,溶液中离子浓度关系正确的是( )
| A. | c(NH4+)=c(Cl-)>c(H+)=c(OH-) | B. | c(NH4+)>c(Cl-)>c(OH-)>c(H+) | ||
| C. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | D. | c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
13.密闭容器中有反应:Mg+2HCl=MgCl2+H2↑ 2s后HCl的浓度由2mol/L减小到1mol/L,求该反应的速率( )
| A. | 1mol/(L•s) | B. | 0.5mol/(L•s) | C. | 1.5 mol/(L•s) | D. | 无法计算 |
10.用惰性电极电解下列溶液时在阴阳两极收集到的气体体积比为2:1的是( )
| A. | H2SO4 | B. | HCl | C. | AgNO3 | D. | NaOH |
14.某饱和一元醇和一元醛的混合物共3g,和足量银氨溶液反应后,还原出16.2g银.下列说法正确的是( )
| A. | 该一元醇也能与银氨溶液反应生成银 | |
| B. | 混合物中一定含有甲醛 | |
| C. | 混合物中醇与醛的物质的量之比为1:3 | |
| D. | 混合物中的一元醛是乙醛 |
15.锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子通过,下列有关叙述正确的是( )
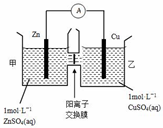

| A. | 电池工作一段时间后,乙池溶液的总质量增加 | |
| B. | 电池工作一段时间后,甲池的c(SO42-)减小 | |
| C. | 铜电极上发生氧化反应 | |
| D. | 阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 |