题目内容
11.下列图示的装置不属于原电池的是( )| A. |  稀硫酸 | B. |  稀硫酸 | C. |  酒精 | D. |  氢氧化钠溶液 |
分析 根据原电池的构成条件分析,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,据此进行判断.
解答 解:A.两电极材料不同,铁较活泼,能与硫酸自发的进行氧化还原反应,形成闭合回路,所以能形成原电池,故A不选;
B.两电极材料不同,锌较活泼,能与硫酸自发的进行氧化还原反应,形成闭合回路,所以能形成原电池,故B不选;
C.酒精不是电解质,金属和酒精不能自发的进行氧化还原反应,所以不能形成原电池,故C选;
D.两电极材料不同,Al与氢氧化钠溶液的反应为自发的进行氧化还原反应,形成闭合回路,所以能形成原电池,故D不选;
故选C.
点评 本题考查了原电池构成条件的判断,题目难度不大,明确原电池工作条件为解答关键,注意掌握原电池工作原理,试题培养了学生的灵活应用基础知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.根据元素周期表和元素周期律分析下面的推断,其中错误的是( )
| A. | 氯气与氢气化合比溴与氢气化合容易 | |
| B. | 硒化氢比硫化氢稳定 | |
| C. | 氢氧化锶比氢氧化钙的碱性强 | |
| D. | 铍的原子失电子能力比镁弱 |
2.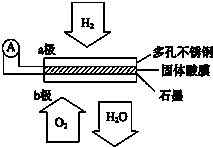 某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( )
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( )
 某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( )
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( )| A. | 电子通过外电路从b极流向a极 | |
| B. | b极上的电极反应式为:O2+2H2O+4e-=4OH- | |
| C. | 每转移0.1 mol电子,消耗标准状况下1.12 L的H2 | |
| D. | OH-由a极通过固体酸电解质传递到b极 |
19.水中加入下列溶液对水的电离平衡不产生影响的是( )
| A. | NaHSO4溶液 | B. | NaCl溶液 | C. | KAl(SO4)2溶液 | D. | KF溶液 |
6.下列关于原子结构、元素性质的说法正确的是( )
| A. | 只含非金属元素的化合物不能形成离子键 | |
| B. | 碱金属元素是同周期中金属性最强的元素 | |
| C. | 同种元素的原子均有相同的质子数和中子数 | |
| D. | 卤族元素的阴离子还原性越强,其最高价氧化物水化物的酸性越强 |
16.某金属的氧化物化学式为MxOy,那么该金属的氯化物的化学式为( )
| A. | MClx | B. | MCl2y/x | C. | MxCly | D. | MyClx |
3.科学家预言,298114F1将是最稳定的同位素,该同位素院子的中子数和质子数之差是( )
| A. | 70 | B. | 114 | C. | 184 | D. | 289 |
20.下列有机反应中,不属于取代反应的是( )
| A. | ClCH2=CH2+NaOH$→_{△}^{H_{2}O}$HOCH2CH═CH2+NaCl | |
| B. | CH2=CHCH3+Cl2→CH2ClCHClCH3 | |
| C. | 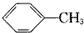 +Cl2$\stackrel{光照}{→}$ +Cl2$\stackrel{光照}{→}$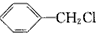 +HCl +HCl | |
| D. | 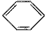 +HONO2$→_{△}^{浓硫酸}$ +HONO2$→_{△}^{浓硫酸}$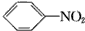 +H2O +H2O |

