题目内容
14.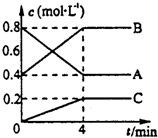 一定条件下,A、B、C三种气体在绝热密闭容器中随反应进行,温度升高;且各物质浓度的变化情况如图所示,通过分析回答:
一定条件下,A、B、C三种气体在绝热密闭容器中随反应进行,温度升高;且各物质浓度的变化情况如图所示,通过分析回答:(1)写出对应反应的化学方程式:2A?2B+C;
(2)前4分钟A的分解速率是0.1 mol/(L•min);其转化率是50%;
(3)4分钟后保持其他条件不变,只改变下列条件,A的体积分数将(填“增大、减小、不变”)
①增大压强:增大;
②降低温度:减小.
分析 (1)由图象可知,A的物质的量浓度减小,B和C的物质的量浓度增加,则A为反应物,B和C为生成物,由反应的浓度的变化之比等于化学计量数之比可得:△c(A):△c(B):△c(C)=0.4mol/L:0.4mol/L:0.2mol/L=2:2:1,则反应的化学方程式为2A?2B+C,
(2)根据v=$\frac{△c}{△t}$计算反应速率,转化率=$\frac{消耗量}{起始量}$×100%;
(3)图象可知4分钟后反应达到平衡状态,增大压强平衡向气体体积减小的方向进行,反应是分解反应属于吸热反应,降低温度平衡逆向进行.
解答 解:(1)由图象可知,A的物质的量浓度减小,B和C的物质的量浓度增加,则A为反应物,B和C为生成物,由反应的浓度的变化之比等于化学计量数之比可得:△c(A):△c(B):△c(C)=0.4mol/L:0.4mol/L:0.2mol/L=2:2:1,则反应的化学方程式为:2A(g)?2B(g)+C(g),
故答案为:2A(g)?2B(g)+C(g);
(2)前4分钟A的浓度变化=0.8mol/L-0.4mol/L=0.4mol/L,分解速率=$\frac{0.4mol/L}{4min}$=0.1 mol/(L•min),A的转化率=$\frac{0.4mol/L}{0.8mol/L}$×100%=50%,
故答案为:0.1 mol/(L•min); 50%;
(3)①4分钟后保持其他条件不变,增大压强平衡向气体体积减小的方向进行,A的体积分数将增大,故答案为:增大;
②4分钟后保持其他条件不变,反应为分解反应属于吸热反应,反应降低温度平衡向放热的方向进行,平衡逆向进行,A的体积分数将减小,故答案为:减小.
点评 本题考查了化学反应速率、化学平衡图象问题,题目难度不大,本题注意根据图象书写反应的化学方程式的方法,化学平衡移动原理是解题关键,掌握基础是解题关键.

| A. | 乙烷(乙烯):通入足量溴水 | |
| B. | 溴乙烷(乙醇):多次加入水振荡,分液,弃水层 | |
| C. | 苯(苯酚):加溴水,振荡,过滤除去沉淀 | |
| D. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层 |
| A. | 0.01g | B. | 0.02g | C. | 0.14g | D. | 0.17g |
 把在空气中久置的铝片5.0g投入盛有50mL 0.1mol•L-1盐酸溶液的烧杯中,该铝片与盐酸反应,产生氢气的速率v(H2)与反应时间t的关系,可用如图所示的坐标曲线来表示,下列推论错误的是( )
把在空气中久置的铝片5.0g投入盛有50mL 0.1mol•L-1盐酸溶液的烧杯中,该铝片与盐酸反应,产生氢气的速率v(H2)与反应时间t的关系,可用如图所示的坐标曲线来表示,下列推论错误的是( )| A. | O→a段不产生氢气是因为表面的氧化物隔离了铝和稀盐酸 | |
| B. | b→c段产生氢气的速率增加较快的主要原因之一是温度升高 | |
| C. | t=c时刻,反应处于平衡 | |
| D. | t>c时,产生氢气的速率降低的主要原因是溶液中H+浓度下降 |
| A. | 甲烷分子  | B. | 乙醇分子  | C. | 苯分子  | D. | 乙烯分子  |
| A. |  干燥Cl2 | B. |  分离乙醇和乙酸 | ||
| C. |  石油的蒸馏 | D. |  分离I2 |
