题目内容
9.蛋白质在一定条件下与浓硫酸反应可转化为硫酸铵,后者在浓氢氧化钠溶液和水蒸气作用下,其中的氮元素可转化为氨气逸出.现用20.00ml牛奶进行上述实验,将牛奶中蛋白质里的氮元素完全转化成氨气,再用50.00ml 0.500mol?L-1硫酸溶液吸收析出的氨,剩余的酸用40.00ml 1.00mol?L-1 氢氧化钠溶液可恰好完全中和.则20.00ml牛奶中共含有蛋白质中氮的质量为( )| A. | 0.01g | B. | 0.02g | C. | 0.14g | D. | 0.17g |
分析 根据氢氧化钠计算剩余的硫酸,进而计算与氨气反应的硫酸的物质的量,再根据关系式2N~2NH3~H2SO4计算氮元素的质量;
解答 解:令40mL1.00mol•L-1的 NaOH溶液中和硫酸的物质的量为n,则:
2NaOH+H2SO4=Na2SO4+2H2O
2 1
0.04L×1mol/L n
解得:n=0.040L×1mol/L×$\frac{1}{2}$=0.02mol
故吸收氨气的硫酸的物质的量为:0.500mol•L-1×0.05mL-0.02mol=0.005mol
令20.0mL牛奶中氮元素的质量是m,则:
2N~2NH3~H2SO4
28g 1mol
m 0.005mol
所以m=28g×$\frac{0.005mol}{1mol}$=0.14g
故选C.
点评 本题考查根据方程式的计算、质量分数的有关计算,难度不大,根据N元素守恒确定蛋白质中氮元素与硫酸反应的关系式是解题关键.

练习册系列答案
相关题目
17.支持固态氨是分子晶体的事实是( )
| A. | 氨极易溶于水 | B. | 铵离子不能独立存在 | ||
| C. | 常温下氨是气态物质 | D. | 氮原子不能形成阳离子 |
4.对于反应2SO2(g)+O2(g)?2SO3(g),一次只改变一个条件,能增大逆反应速率的措施是( )
| A. | 增大容器体积 | B. | 通入大量O2 | C. | 移去部分SO2 | D. | 降低体系温度 |
15.有关离子交换法软化硬水的下列叙述中,正确的是( )
| A. | 磺化煤能使具有永久硬度的水软化,因为它能除去水中的Ca2+、Mg2+、SO42-和Cl-等 | |
| B. | 经磺化煤软化处理后,软水中Na+浓度增大 | |
| C. | 磺化煤使硬水软化以及磺化煤的再生,这两种操作可以在同一离子交换柱中同时进行 | |
| D. | 失去软化硬水能力的磺化煤,不可能恢复它的软化能力 |

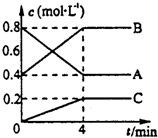 一定条件下,A、B、C三种气体在绝热密闭容器中随反应进行,温度升高;且各物质浓度的变化情况如图所示,通过分析回答:
一定条件下,A、B、C三种气体在绝热密闭容器中随反应进行,温度升高;且各物质浓度的变化情况如图所示,通过分析回答: