题目内容
14.下列叙述正确的是( )| A. | 浓度均为0.2mol•L-1的NH4Cl溶液与NaOH溶液混合,c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| B. | 仅含有Na+、H+、OH-、CH3COO-四种离子的某溶液中可能存c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| C. | 常温下,pH=2的醋酸与pH=12的氢氧化钠等体积混合后,混合液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 将pH=8.5的氨水加水稀释后,溶液中所有离子的浓度均降低 |
分析 A.二者恰好完全反应生成NaCl和NH3.H2O,NH3.H2O为弱电解质部分电离,溶液呈碱性,结合物料守恒判断;
B.如果溶液中溶质为NaOH和CH3COONa且NaOH浓度远远大于CH3COONa浓度,则存在c(OH-)>c(CH3COO-);
C.pH=2的醋酸浓度大于NaOH溶液,二者等体积混合后醋酸有剩余,醋酸电离程度大于醋酸根离子水解程度导致溶液呈酸性;
D.pH=8.5的氨水加水稀释后,促进一水合氨电离,溶液中只有c(H+)增大.
解答 解:A.二者恰好完全反应生成NaCl和NH3.H2O,NH3.H2O为弱电解质部分电离,溶液呈碱性,结合物料守恒得c(Cl-)=c(Na+)>c(NH4+)>c(OH-)>c(H+),故A错误;
B.如果溶液中溶质为NaOH和CH3COONa且NaOH浓度远远大于CH3COONa浓度,则存在c(OH-)>c(CH3COO-),结合物料守恒得c(Na+)>c(OH-)>c(CH3COO-)>c(H+),故B正确;
C.pH=2的醋酸浓度大于NaOH溶液,二者等体积混合后醋酸有剩余,醋酸电离程度大于醋酸根离子水解程度导致溶液呈酸性则c(OH-)<c(H+),结合电荷守恒得c(Na+)<c(CH3COO-),则溶液中离子浓度大小顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-),
故C错误;
D.pH=8.5的氨水加水稀释后,促进一水合氨电离,溶液中铵根离子、一水合氨及氢氧根离子浓度都减小,温度不变水的离子积常数不变,则溶液中c(H+)增大,故D错误;
故选B.
点评 本题考查离子浓度大小比较,为高频考点,侧重考查学生分析判断及知识灵活运用能力,明确溶液中溶质及其性质、溶液酸碱性是解本题关键,注意电荷守恒和物料守恒的灵活运用,易错选项是D.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案①6.72L CH4 ②3.01×1023个HCl分子
③13.6g H2S ④0.2mol NH3,下列对这四种气体的关系排列的组合中正确的是( )
a.体积:②>③b.密度:④>①c.质量:③>①d.氢原子个数:①>②
| A. | abc | B. | bcd | C. | abd | D. | abcd |
| A. | 氨水 | B. | Ba(OH)2溶液 | C. | 盐酸 | D. | NaOH溶液 |
| A. | 镀锌铁片比镀锡铁片更耐腐蚀 | |
| B. | 远洋海轮的尾部装上一定数量的锌板 | |
| C. | 用锌与硫酸制氢气时,往硫酸中滴少量硫酸铜 | |
| D. | 常温条件下,在空气中铝不易被腐蚀 |
| A. | 酸和醇发生的反应一定是酯化反应 | |
| B. | 由乙烯生成乙醇属于还原反应 | |
| C. | 在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应 | |
| D. | 油脂的皂化反应属于加成反应 |
| A. | 3s2表示3s能级有两个轨道 | |
| B. | 处于最低能量的原子叫做基态原子 | |
| C. | 同一原子中,1s、2s、3s电子的能量逐渐减小 | |
| D. | 同一原子中,3d、4d、5d能级的轨道数依次增多 |
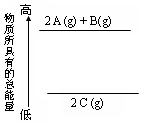
| A. | 2A+B=2C;△H<0 | B. | 2C(g)=2 A(g)+B(g);△H<0 | ||
| C. | 2A(g)+B(g)=2 C(g);△H>0 | D. | 2A(g)+B(g)=2 C(g);△H<0 |
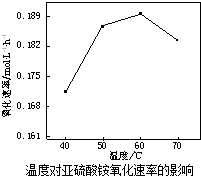 利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下:
利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下: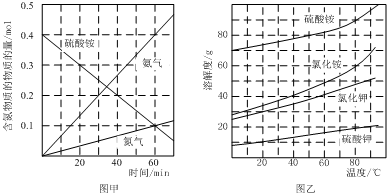
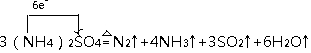 .
. .
.