题目内容
4.X、Y、Z、W、L、M六种短周期主族元素的原子序数依次增大,其中X、M的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,Z在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料.用化学用语回答下列问题:(1)L在元素周期表中的位置为第三周期第 IVA族.
(2)Y、M的氢化物的稳定性由小到大的顺序是CH4<HCl(用化学式表示)
(3)Y的最高价氧化物的化学式为CO2.原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
分析 W是地壳中含量最多的金属元素,则W是Al;L的单质晶体熔点高、硬度大,是一种重要的半导体材料,且原子序数大于铝的,所以L是Si;X、M的单质是气体,原子序数大于Si的,所以M是Cl;Y的原子最外层电子数是其电子层数的2倍,原子序数小于铝的,所以Y是C;X的原子序数小于C的,所以X是氢;Z在同周期的主族元素中原子半径最大,则Z是Na,由此分析解答.
解答 解:W是地壳中含量最多的金属元素,则W是Al;L的单质晶体熔点高、硬度大,是一种重要的半导体材料,且原子序数大于铝的,所以L是Si;X、M的单质是气体,原子序数大于Si的,所以M是Cl;Y的原子最外层电子数是其电子层数的2倍,原子序数小于铝的,所以Y是C;X的原子序数小于C的,所以X是氢;Z在同周期的主族元素中原子半径最大,则Z是Na,
(1)L是硅元素,原子序数为14,在周期表中的位置为第三周期第 IVA 族,
故答案为:第三周期第 IVA 族;
(2)碳的非金属性弱于氯的非金属性,所以氢化物的稳定性由小到大的顺序是CH4<HCl,
故答案为:CH4<HCl;
(3)Y为C元素,其的最高价氧化物为CO2;原子序数比C多2的是氧,和氢形成的化合物双氧水分解生成氧气和水,反应方程式为:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,
故答案为:CO2;2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
点评 本题考查结构、结构与性质的关系,题目难度中等,推断元素是解题的关键,注意熟练掌握元素周期律内容、元素周期表结构,试题培养了学生的分析、理解能力及灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.以下说法正确的是( )
| A. | 氯气和氯水都能使干燥的有色布条褪色 | |
| B. | MnO2和FeCl3均能增大H2O2分解的反应速率 | |
| C. | 氢氧化钠和氢氧化铝都是常用的中和胃酸的药物 | |
| D. | 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 |
5.有关天然产物水解的叙述不正确的是( )
| A. | 纤维素水解与淀粉水解得到的最终产物不同 | |
| B. | 蛋白质水解的最终产物均为氨基酸 | |
| C. | 可用碘检验淀粉水解是否完全 | |
| D. | 油脂水解可得到丙三醇 |
9.下列关于0.2mol•L-1的Ca(NO3)2溶液的叙述中,不正确的是( )
| A. | 100mL的该溶液中含3.28g溶质 | |
| B. | .500mL的该溶液中含0.2molNO3- | |
| C. | 600mL的该溶液中Ca2+与NO3的物质的量浓度之比是1:2 | |
| D. | .800nmL的该溶液中NO3-的总浓度为3.2mol•L-1. |
16.下列物质的熔点高低顺序,正确的是( )
| A. | 金刚石>晶体硅>碳化硅 | B. | K>Na | ||
| C. | HCHO<CH3OH | D. | NaF<NaCl<NaBr |
13.“促进低碳经济”是世界环境日的主题,《联合国气候变化框架公约》第15次缔约方会议也商讨了2012年至2020年的全球减排协议.下列行为中不符合“促进低碳经济”宗旨的是( )
| A. | 研究采煤、采油新技术,提高产量以满足工业生产的快速发展 | |
| B. | 将煤进行气化处理,提高煤的综合利用效率 | |
| C. | 开发太阳能、水能、风能、可燃冰等新能源,减少使用煤、石油等化石燃料 | |
| D. | 实现资源的“3R”利用观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生(Recycle) |
 某化学课外小组查阅资料知:苯和液溴在有铁存在的条件下可反应生成溴苯和溴化氢,此反应为放热反应,他们用图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组查阅资料知:苯和液溴在有铁存在的条件下可反应生成溴苯和溴化氢,此反应为放热反应,他们用图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中. ;
; )和新
)和新 ) ⑤
) ⑤ 和
和 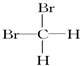 ⑥甲烷和丙烷
⑥甲烷和丙烷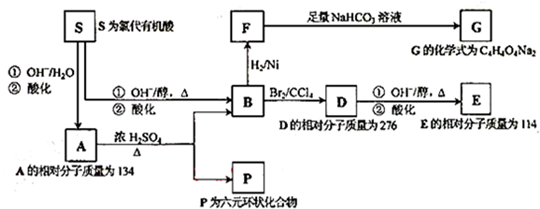
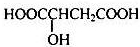 、P:
、P: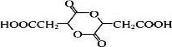 、E:HOOCC≡CCOOH、S:
、E:HOOCC≡CCOOH、S: .
. .
.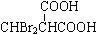
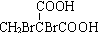 .
.