题目内容
17.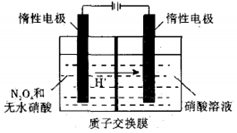 N2O5是绿色硝化试剂,溶于水可得硝酸.图是以N2O4为原料电解制备N2O5的装置示意图写出阳极区生成N2O5的电极反应式是N2O4-2e-+2HNO3=2N2O5+2H+.
N2O5是绿色硝化试剂,溶于水可得硝酸.图是以N2O4为原料电解制备N2O5的装置示意图写出阳极区生成N2O5的电极反应式是N2O4-2e-+2HNO3=2N2O5+2H+.
分析 N2O4可电解制备绿色硝化试剂N2O5.N元素化合价升高,N2O4被氧化,为电解池阳极反应,据此书写.
解答 解:N2O4可电解制备绿色硝化试剂N2O5.N元素化合价升高,N2O4被氧化,电极方程式为N2O4-2e-+2HNO3=2N2O5+2H+,
故答案为:N2O4-2e-+2HNO3=2N2O5+2H+.
点评 本题考查电解池的原理,着重阳极电极方程式的书写,题目难度中等,注意基础知识的积累.

练习册系列答案
相关题目
7.下列有关说法正确的是( )
| A. | NH4HSO3与足量的2 mol/L硫酸溶液混合微热,产生的刺激性气味的气体是NH3 | |
| B. | 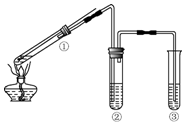 用如图所示装置探究铜丝与过量浓硫酸的反应,为确认CuSO4生成,向①中加水,观察颜色 | |
| C. | 取适量铁粉与一定量的稀硝酸恰好完全反应,体现酸性的硝酸与体现氧化性的硝酸的物质的量之比为3:1 | |
| D. | 电解熔融氯化铝制备金属铝 |
8.对下列物质的化学用语书写正确的是 ( )
| A. | 乙烯的结构简式为CH2CH2 | B. | 氢氧根的电子式: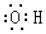 | ||
| C. | Ca2+的结构示意图为  | D. | 溴乙烷的分子式:CH3CH2Br |
5.设NA为阿伏加德罗常数,如果a g某气态双原子分子的分子数为p,则b g该气体在标准状况下的体积V(L)是( )
| A. | $\frac{22.4pb}{a{N}_{A}}$ | B. | $\frac{22.4ab}{p{N}_{A}}$ | C. | 22.4NAba | D. | $\frac{22.4ap}{b{N}_{A}}$ |
12.下列溶液中物质的量浓度为1mol•L-1的是( )
| A. | 将58.5 g NaCl溶解于1 L 水中 | |
| B. | 将22.4 L氨气溶于水配成1 L溶液 | |
| C. | 将1 L 10 mol•L-1的浓盐酸与9 L水混合 | |
| D. | 将10 g NaOH溶解在水中配成250 mL溶液 |
2.下列变化中,属于还原反应的是( )
| A. | KMnO4→MnO2 | B. | FeCl2→FeCl3 | C. | C→CO2 | D. | Cl-→Cl2 |
6.下列有关热化学方程式的叙述正确的是( )
| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 已知2C(s)+2O2(g)═2CO2(g)△H12C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 | |
| D. | 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应中和热的热方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ/mol |