题目内容
7.t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw=10-13.该温度下(t℃),1体积的稀硫酸和10体积的NaOH溶液混合后溶液呈中性,则稀硫酸的pH(pHa)与NaOH溶液的pH(pHb)的关系是:pHa+pHb=12.分析 pH=2的H2SO4溶液中氢离子的物质的量浓度为10-2mol/L,设该温度下水的离子积常数Kw=10-a,则pH=11的NaOH溶液中氢氧根离子浓度为:$\frac{1{0}^{-a}}{1{0}^{-11}}$mol/L,据此计算出a即可,根据硫酸中氢离子与氢氧化钠中氢氧根离子的物质的量判断过量,然后计算出反应后溶液中氢离子浓度,最后计算出其余的pH.
解答 解:设该温度下设该温度下水的离子积常数Kw=10-a,pH=2的H2SO4溶液中氢离子的浓度为10-2mol/L,
pH=11的NaOH溶液中氢离子浓度为10-11mol/L,则氢氧根离子浓度为:$\frac{1{0}^{-a}}{1{0}^{-11}}$mol/L=10(11-a)mol/L,
等体积的氢氧化钠、稀硫酸恰好反应,则氢离子与氢氧根离子浓度相等,即10-2mol/L=10(11-a)mol/L,解得a=13,
水的离子积常数Kw=10-13,
若1体积pH1=pHa的稀硫酸溶液中氢离子的物质的量浓度=10-pHa mol/L,10体积pH2=b的某强碱溶液中氢氧根离子的物质的量浓度=10 pHb-13 mol/L,混合后溶液呈中性,则氢离子的物质的量等于氢氧根离子的物质的量,所以1×10-pHa mol/L=10×10 pHb-13 mol/L,所以pHa+pHb=12,
故答案为:10-13;pHa+pHb=12.
点评 本题考查了酸碱混合后溶液定性判断及溶液pH的简单计算,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
16.下列各组物质相互混合,既有气体生成又有沉淀生成的是( )
①金属钠投入到CuSO4溶液中
②过量的NaOH溶液和明矾溶液
③NaAlO2溶液和NaHCO3溶液混合
④过量的Na2O2投入FeCl2溶液
⑤金属钠投入NH4Cl溶液中.
①金属钠投入到CuSO4溶液中
②过量的NaOH溶液和明矾溶液
③NaAlO2溶液和NaHCO3溶液混合
④过量的Na2O2投入FeCl2溶液
⑤金属钠投入NH4Cl溶液中.
| A. | ①④ | B. | ②③ | C. | ②③ | D. | ①⑤ |
17.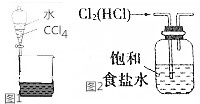 下列关于物质的分离提纯不正确的是( )
下列关于物质的分离提纯不正确的是( )
 下列关于物质的分离提纯不正确的是( )
下列关于物质的分离提纯不正确的是( )| A. | 用如图1所示装置分离CCl4和水 | |
| B. | 除去苯中的少量苯酚,加入适量浓溴水,过滤 | |
| C. | 实验室用如图2所示装置除去Cl2中的少量HCl | |
| D. | 除去O2中混有得得少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |
2.白钨矿的主要成分是钨酸钙(CaWO4),其中钨的化合价为( )
| A. | +3 | B. | +4 | C. | +6 | D. | +7 |
12.某研究性学习小组设想将少量Cl2通入Fe2+和I-的混合溶液中,探究Fe2+和I-的还原性强弱.
假设1:Fe2+还原性比I-强.假设2:I-还原性比Fe2+强.
选择几种装置进行实验:
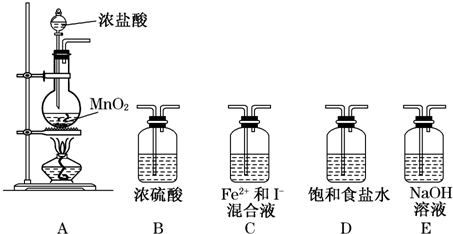
(1)实验必需的装置是A→C→E(按Cl2气流方向的顺序填写).
(2)请在下表中写出实验步骤及预期现象和结论.
(3)为了实验成功,必须控制各物质的量.该小组称取1.52g FeSO4固体,同时称取1.66g KI固体,溶于水中配成混合溶液.为了验证上述假设,通入的Cl2体积最多不能超过0.112L(标准状况).
(4)有同学质疑,上述实验中Cl2量很难控制,无法验证Fe2+和I-反应的先后顺序.于是提出另一方案:往KI溶液中滴入FeCl3溶液,如果能发生反应,即可证明I-的还原性强于Fe2+.
假设1:Fe2+还原性比I-强.假设2:I-还原性比Fe2+强.
选择几种装置进行实验:

(1)实验必需的装置是A→C→E(按Cl2气流方向的顺序填写).
(2)请在下表中写出实验步骤及预期现象和结论.
| 实验步骤 | 预期现象和结论 |
| 取少量反应后的混合溶液分别置于A、B两试管中:往A中滴加KSCN溶液;往B中滴加淀粉溶液 | ①A中溶液变红,B中溶液不变蓝, 则假设1成立. ②A中溶液不变红,B中溶液变蓝, 则假设2成立. |
(4)有同学质疑,上述实验中Cl2量很难控制,无法验证Fe2+和I-反应的先后顺序.于是提出另一方案:往KI溶液中滴入FeCl3溶液,如果能发生反应,即可证明I-的还原性强于Fe2+.
19.下列物质不能破坏水的电离平衡的是( )
| A. | NaCl | B. | H2S | C. | Na2S | D. | NH4Cl |
16.制烧碱所用盐水需两次精制.第一次精制主要是用沉淀法除去粗盐水中ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
I.向粗盐水中加入过量BaCl2溶液,过滤;
II.向所得滤液中加入过量Na2C03溶液,过滤;
III.滤液用盐酸调节pH,获得一次精制盐水.
(1)过程I、II生成的部分沉淀及其溶解度(20°C/g)如下表:
①检测Fe3+是否除尽的方法是取少量过程II后的滤液于试管中,滴加几滴KSCN溶液,若溶液不变红,说明Fe3+已除尽,反之没除尽.
②过程I选用BaCl2而不选用CaCl2,运用表中数据解释原因BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完.
③除去Mg2+的离子方程式是2Mg2++2CO32-+H2O═Mg2(OH)2CO3↓+CO2↑.
④检测ca2+、Mg2+、B2+是否除尽时,只需检测Ba2+(填离子符号).
(2)第二次精制要除去微量的Iˉ、IO3ˉ、NH4+、Ca2+、Mg2+,流程示意如下: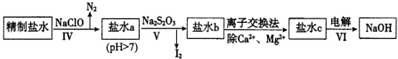
①过程IV除去的离子是NH4+、I-.
②盐水b中含有SO42-.Na2S203将IO3-还原为12的离子方程式是5S2O32-+8IO3-+2OH-═4I2+10SO42-+H2O.
③过程VI中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释:H+在阴极上得电子变成H2逸出,使H2O?H++OH-电离平衡向右移动,OH-在阴极区浓度增大,Na+向阴极区移动,最后NaOH在阴极区生成.
I.向粗盐水中加入过量BaCl2溶液,过滤;
II.向所得滤液中加入过量Na2C03溶液,过滤;
III.滤液用盐酸调节pH,获得一次精制盐水.
(1)过程I、II生成的部分沉淀及其溶解度(20°C/g)如下表:
| CaS04 | Mg2(OH)2C03 | CaC03 | BaS04 | BaC03 |
| 2.6×1 0-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×1 0-3 |
②过程I选用BaCl2而不选用CaCl2,运用表中数据解释原因BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完.
③除去Mg2+的离子方程式是2Mg2++2CO32-+H2O═Mg2(OH)2CO3↓+CO2↑.
④检测ca2+、Mg2+、B2+是否除尽时,只需检测Ba2+(填离子符号).
(2)第二次精制要除去微量的Iˉ、IO3ˉ、NH4+、Ca2+、Mg2+,流程示意如下:

①过程IV除去的离子是NH4+、I-.
②盐水b中含有SO42-.Na2S203将IO3-还原为12的离子方程式是5S2O32-+8IO3-+2OH-═4I2+10SO42-+H2O.
③过程VI中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释:H+在阴极上得电子变成H2逸出,使H2O?H++OH-电离平衡向右移动,OH-在阴极区浓度增大,Na+向阴极区移动,最后NaOH在阴极区生成.
17.下列说法错误的是( )
| A. | 食物放在冰箱中会减慢食物变质的速率 | |
| B. | 钾的金属性强,所以钾与水的反应比钠的反应剧烈 | |
| C. | 2mol SO2与1mol O2混合反应后一定能生成2 mol SO3 | |
| D. | 面粉厂严禁烟火的原因是面粉粉尘表面积大,与空气接触遇明火极易发生爆炸 |
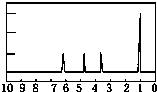 有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验: .
. +2H2O.
+2H2O.