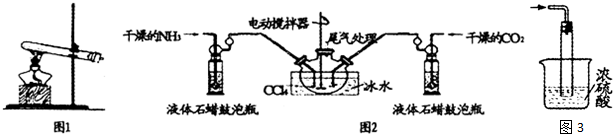
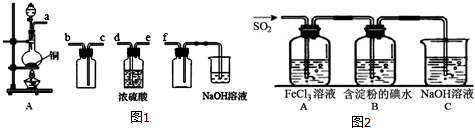
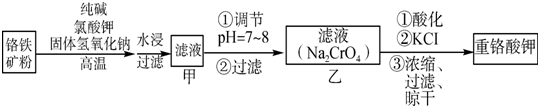
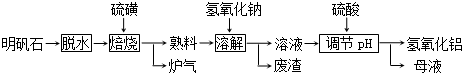
题目内容
15.某温度下,在 2L 的密闭容器中,加入 1mol X(g)和 2mol Y(g)发生反应:X(g)+mY(g)?3Z(g)平衡时,X、Y、Z 的体积分数分别为 30%、60%、10%.在此平衡体系中加入 1mol Z(g),再次达到平衡后,X、Y、Z 的体积分数不变.下列叙述不正确的是( )| A. | m=2 | |
| B. | X 与 Y 的平衡转化率之比为 1:2 | |
| C. | 两次平衡的平衡常数相同 | |
| D. | 第二次平衡时,Z 的浓度为 0.2 mol•L-1 |
分析 A.向平衡体系中再加入1molZ,重新建立平衡时X、Y、Z的体积分数不变,说明压强不影响该平衡,则反应前后总计量数相等,则1+m=3,m=2;
B.X、Y的初始浓度之比为1:2,计量数之比为1:2,则二者的转化率相等;
C.K只与温度有关;
D.根据重新达到平衡时Z的体积分数不变及反应过程中总物质的量不变计算出Z的物质的量,再根据c=$\frac{n}{V}$计算出Z的浓度,以此来解答.
解答 解:A.向平衡体系中再加入1molZ,重新建立平衡时X、Y、Z的体积分数不变,说明压强不影响该平衡,则反应前后总计量数相等,则1+m=3,m=2,故A正确;
B.向2L的密闭容器中加入1molX和2molY,由于m=2,则反应过程中消耗X、Y的物质的量之比为1:2,所以X、Y的转化率一定相等,故B错误;
C.K只与温度有关,温度不变,则两次平衡的平衡常数相同,故C正确;
D.再加入1molZ后总物质的量为4mol,重新达到平衡时Z的体积分数仍然为10%,则重新建立平衡时Z的浓度为$\frac{4mol×10%}{2}$=0.2mol/L,故D正确;
故选B.
点评 本题考查化学平衡的计算,为高频考点,把握压强对平衡移动的影响判断m及等效平衡为解答的关键,侧重分析与应用能力的考查,注意利用体积分数不变判断化学计量数关系,题目难度不大.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
20.在无土栽培中,需配制一定组成的植物营养液.已知某植物营养液的配方为0.6mol KCl、0.4mol K2SO4、0.20mol ZnSO4和1LH2O.若以KCl、K2SO4、ZnCl2和1LH2O为原料配得相同组成的营养液,需三种溶质的物质的量为( )
| A. | 0.20 mol、0.60 mol、0.20mol | B. | 0.30 mol、0.60 mol、0.10 mol | ||
| C. | 0.40 mol、0.60 mol、0.10 mol | D. | 0.20 mol、0.10mol、0.60 mol |
20.已知在101kPa、298K条件下2mol氢气燃烧生成水蒸气,放出484kJ热量.下列热化学方程式中,正确的是( )
| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+242kJ•mol-1 | B. | 2H2(g)+O2(g)=2H2O(l)△H=+484kJ•mol-1 | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-242kJ•mol-1 | D. | 2H2(g)+O2(g)=2H2O(g)△H=-484kJ•mol-1 |
7.(1)甲同学在用FeSO4固体配制FeSO4溶液时,除了加入蒸馏水外,还需加Fe和H2SO4试剂(填化学式)
(2)乙同学为标定某醋酸溶液的准确浓度,用0.2000mol•L-1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如表:
则该醋酸溶液的准确浓度为0.2000mol/L.(保留小数点后四位)
(3)丙同学利用:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O反应,用KMnO4溶液滴定某样品进行铁元素含量的测定.
①设计的下列滴定方式,最合理的是b.(夹持部分略去)(填字母序号)
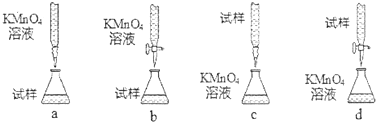
②判断滴定终点的依据是当滴下最后一滴KMnO4标准溶液时,溶液颜色变为浅紫红色,且在半分钟内不褪色.
(2)乙同学为标定某醋酸溶液的准确浓度,用0.2000mol•L-1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如表:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
(3)丙同学利用:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O反应,用KMnO4溶液滴定某样品进行铁元素含量的测定.
①设计的下列滴定方式,最合理的是b.(夹持部分略去)(填字母序号)

②判断滴定终点的依据是当滴下最后一滴KMnO4标准溶液时,溶液颜色变为浅紫红色,且在半分钟内不褪色.