题目内容
在恒容条件下,能使NO2(g)+CO(g)?CO2(g)+NO (g)正反应速率增大且活化分子的百分数也增加的措施是( )
| A、增大NO2或CO的浓度 |
| B、减小CO2或NO的浓度 |
| C、通入Ne使气体的压强增大 |
| D、升高反应的温度 |
考点:化学反应速率的影响因素
专题:
分析:升高、加压、增大浓度、使用正催化剂,均可加快反应速率,但温度、催化剂改变活化分子百分数,以此来解答.
解答:
解:A、B为改变浓度,可改变反应速率,但活化分子的百分数不变,C通入Ne使气体的压强增大,不改变参加反应气体的浓度,反应速率不变;
升高温度,可增大活化分子百分数,反应速率增大,
故选D.
升高温度,可增大活化分子百分数,反应速率增大,
故选D.
点评:本题考查影响反应速率的因素,注意活化分子数目与百分数的差别,明确温度、浓度、压强对反应速率的影响即可解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
24mL浓度为0.05mol?L-1的Na2SO3溶液,恰好与20mL浓度为0.02mol?L-1的K2Cr2O7溶液完全反应,已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为( )
| A、+2 | B、+3 | C、+4 | D、+5 |
下列物质中,不属于电解质的是( )
| A、H2SO4 |
| B、AgCl |
| C、NaOH |
| D、酒精 |
美籍华裔科学家钱永健曾于2008年获得诺贝尔化学奖.16岁时,他凭借一个金属易受硫氰酸盐腐蚀的调查项目,荣获有“少年诺贝尔奖”之称的著名奖项.下列说法正确的是( )
| A、金属的电化学腐蚀和化学腐蚀都是金属原子失去电子而被还原的过程 |
| B、钢铁发生电化学腐蚀时,其先发生反应:Fe-3e-=Fe3+,继而形成铁锈 |
| C、减少钢铁中的含碳量,可以增强钢铁的耐腐蚀能力 |
| D、金属的腐蚀会给社会带来巨大损失,所以金属的腐蚀是百害无一利的 |
在反应SiO2+3C=SiC+2CO中,氧化剂和还原剂质量之比是( )
| A、1:3 | B、3:1 |
| C、1:2 | D、2:1 |
实验室需配制一种仅含四种离子(不考虑水的电离)的混合溶液,且在混合溶液中四种离子的物质的量浓度均为0.1mol/L.下面四个选项中能达到此目的是( )
| A、Na+、K+、SO42-、Cl- |
| B、Fe2+、H+、SO42-、NO3- |
| C、H+、K+、HCO3-、Cl- |
| D、Mg2+、Na+、Cl-、SO42- |
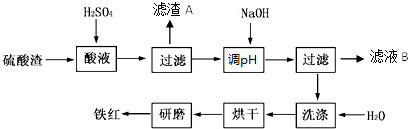
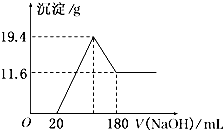 将可能含有少量碳、硅杂质的a克镁铝合金投入100mL一定物质的量浓度的盐酸中,合金部分溶解,过滤,向所得溶液中滴加5mol/L NaOH溶液至过量,生成沉淀的质量与加入氢氧化钠溶液的体积的关系如图所示.
将可能含有少量碳、硅杂质的a克镁铝合金投入100mL一定物质的量浓度的盐酸中,合金部分溶解,过滤,向所得溶液中滴加5mol/L NaOH溶液至过量,生成沉淀的质量与加入氢氧化钠溶液的体积的关系如图所示.