题目内容
12.氮是地球上较丰富的元素,氮及其化合物在生活、工农业生产、高科技产业中具有重要的作用.(1)工业上利用分离液态空气的方法得到氮气,从液态空气中得到氮气的方法为液态空气的分馏.
(2)①肼(N2H4)又称联氨,是良好的火箭燃料,NH3和NaClO反应可得到肼,该反应的化学方程式为2NH3+NaClO=N2H4+NaCl+H2O.
②肼被亚硝酸(HNO2)氧化时可生成氢叠氮酸(HN3),该反应的化学方程式为N2H4+HNO2═HN3+2H2O.
(3)氢叠氮酸(HN3)常用引爆剂,受到撞击时爆炸分解成常见的两种单质,分解时的化学方程式为2HN3=H2↑+3N2↑.
(4)如图是工业上合成硝酸铵的流程图.
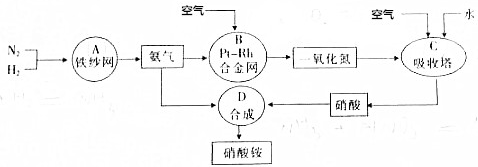
①上述A、B、C、D四个容器中发生的反应,不属于氧化还原反应的是ABC.
②该工艺中,若氨气制NO的产率是96%,NO制硝酸的产率是92%,则制硝酸所用的氨气的质量占消耗氨气总质量的53.1%(不考虑生产中的其他损耗)
分析 (1)工业制氮气的原理是分离液态空气,其方法是将空气加压降温成液态空气,然后略微升温,沸点低的先逸出;
(2)①NH3与NaClO反应可得到肼(N2H4),N元素的化合价升高,故还生成氯化钠与水;
②肼和亚硝酸(HNO2)反应时发生归中反应生成氢叠氮酸(HN3),H和O元素未发生氧化还原反应,据此书写化学方程式;
(3)氢叠氮酸(HN3)只由两种元素构成,故受撞击时爆炸分解成常见的两种单质为氢气和氮气,据此书写反应;
(4)①根据反应中各物质的组成元素的化合价是否发生变化来判断是否发生氧化还原反应;
②根据NH3制NO的产率是96%、NO制HNO3的产率是92%,利用氮原子守恒来计算硝酸的量,再由HNO3跟NH3反应生成NH4NO3来计算氨气的量,最后计算制HNO3所用去的NH3的质量占总耗NH3质量的百分数.
解答 解:(1)氧气的沸点是-183℃,氮气的沸点是-196℃,工业制氮气的原理是分离液态空气,其方法是将空气加压降温成液态空气,然后略微升温,沸点低的氮气先逸出,此方法为液态空气的分馏,故答案为:液态空气的分馏;
(2)①NH3与NaClO发生氧化还原反应可得到肼(N2H4)、氯化钠和水,所以该反应的化学方程式为:2NH3+NaClO=N2H4+NaCl+H2O,
故答案为:2NH3+NaClO=N2H4+NaCl+H2O;
②肼和亚硝酸(HNO2)反应时发生归中反应生成氢叠氮酸(HN3),H和O元素未发生氧化还原反应,故化学方程式为N2H4+HNO2═HN3+2H2O,故答案为:N2H4+HNO2═HN3+2H2O;
(3)氢叠氮酸(HN3)只由两种元素构成,故受撞击时爆炸分解成常见的两种单质为氢气和氮气,故化学方程式为:2HN3=H2↑+3N2↑,故答案为:2HN3=H2↑+3N2↑;
(4)①题中涉及的化学反应有:A、N2+3H2?2NH3,B、4NH3+5O2 $\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O,C、2NO+O2═2NO2、3NO2+H2O═2HNO3+NO、4NO2+O2+H2O═4HNO3,D、NH3+HNO3═NH4NO3,其中A、B、C属于氧化还原反应,
故答案为:ABC;
②由NH3制NO的产率是96%、NO制HNO3的产率是92%,根据氮原子守恒可知,NH3~NO~HNO3,则1mol氨气可得到硝酸1mol×96%×92%=0.8832mol,由HNO3+NH3═NH4NO3,则该反应消耗的氨气的物质的量为0.8832mol,氨气的质量之比等于物质的量之比,
则制HNO3所用去的NH3的质量占总耗NH3质量的百分数为:$\frac{1mol}{1mol+0.8832mol}$×100%=53.1%,
故答案为:53.1%.
点评 本题考查了氧化还原反应的判断、化学方程式的书写等知识,题目难度稍大,试题题量较大,涉及的知识点较多,充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

 53随堂测系列答案
53随堂测系列答案| A. | 蔗糖 | B. | 饱和食盐水 | C. | 盐酸 | D. | KOH |
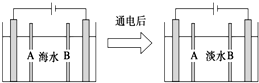
| A. | 阳离子交换膜是A,不是B | |
| B. | 通电后阳极区的电极反应式:2Cl--2e-═Cl2↑ | |
| C. | 工业上阴极使用铁丝网代替石墨碳棒,增大反应接触面 | |
| D. | 阴极区的现象是电极上产生无色气体,溶液中出现少量白色沉淀 |
| A. | Fe2+ | B. | HCO3- | C. | Fe3+ | D. | OH- |
| A. | 0.2mol•L-1 | B. | 0.16mol•L-1 | C. | 0.32mol•L-1 | D. | 0.08mol•L-1 |
| A. | 碳棒上放出氯气 | B. | 碳棒上放出氧气 | C. | 碳棒附近产生OH- | D. | 铁钉被还原 |
 取6根铁钉,6支干净的试管及其他材料,如图所示.
取6根铁钉,6支干净的试管及其他材料,如图所示.