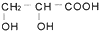题目内容
设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A、1mol过氧化钠固体与足量的水反应,转移的电子数目为2NA |
| B、Fe在1molCl2中充分燃烧,转移的电子数目为3NA |
| C、将含有0.1molFeCl3的FeCl3饱和溶液,滴入沸水中加热形成Fe(OH)3胶体,所含的胶体粒子数目少于0.1NA |
| D、足量的MnO2粉末与含有4molHCl的浓盐酸充分反应,转移的电子数目为2NA |
考点:阿伏加德罗常数
专题:
分析:A.过氧化钠中氧元素化合价为-1价,根据1mol过氧化钠完全反应生成的氧气的物质的量计算出转移的电子数;
B、1molCl2只需要得到2mol电子;
C、0.1mol FeCl3滴人沸水形成的氢氧化铁胶体,氢氧化铁胶体粒子为氢氧化铁的聚集体;
D、浓盐酸随着反应进行,浓度变稀后不再与二氧化锰反应.
B、1molCl2只需要得到2mol电子;
C、0.1mol FeCl3滴人沸水形成的氢氧化铁胶体,氢氧化铁胶体粒子为氢氧化铁的聚集体;
D、浓盐酸随着反应进行,浓度变稀后不再与二氧化锰反应.
解答:
解:A.1mol过氧化钠与足量的水反应生成0.5mol氧气,转移了1mol电子,反应转移NA个电子,故A错误;
B.1molCl2只需要得到2mol电子,故转移电子数为2NA,故B错误;
C.将含有0.1molFeCl3的FeCl3饱和溶液,滴入沸水中加热形成Fe(OH)3胶体,所含的胶体粒子数目少于0.1NA,故C正确;
D.浓盐酸随着反应进行,浓度变稀后不再与二氧化锰反应,故浓盐酸不能完全,所以生成的氯气分子数小于2NA,故D错误;
故选C.
B.1molCl2只需要得到2mol电子,故转移电子数为2NA,故B错误;
C.将含有0.1molFeCl3的FeCl3饱和溶液,滴入沸水中加热形成Fe(OH)3胶体,所含的胶体粒子数目少于0.1NA,故C正确;
D.浓盐酸随着反应进行,浓度变稀后不再与二氧化锰反应,故浓盐酸不能完全,所以生成的氯气分子数小于2NA,故D错误;
故选C.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意过氧化钠中氧元素的化合价为-1价;掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系;选项D为易错点.

练习册系列答案
相关题目
下列有关物质的性质及应用说法正确的是( )
| A、BaSO4饱和溶液中加入饱和Na2CO3溶液有白色沉淀产生,说明Ksp(BaSO4)大于Ksp(BaCO3) |
| B、H2C2O4、SO2都能使酸性高锰酸钾溶液褪色,前者表现出还原性后者表现出漂白性 |
| C、SiO2具有导电性,可用于制造半导体材料 |
| D、油脂的种类很多,但它们水解后一定都有一种产物相同 |
在盛放浓硫酸的试剂瓶上应印有如图所示警示标记中的( )
A、 |
B、 |
C、 |
D、 |
元素C、N、O、中,第一电离能最大的是( )
| A、C | B、N | C、O | D、不能比较 |
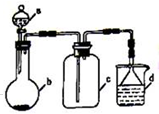 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( ) .
.
 的同分异构体中同时符合下列条件的芳香族化合物共有
的同分异构体中同时符合下列条件的芳香族化合物共有
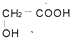 ④
④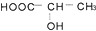 ⑤
⑤ ⑥
⑥