题目内容
(1)有下列一些物质,根据要求回答下列问题:
①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧I2 ⑨He
只含有离子键的是(用序号回答) ,含有共价键的离子化合物是(用序号回答) ,含有共价键的共价化合物是(用序号回答) ,常温时为固体,当其熔化时,不破坏化学键的是(用序号回答) .
(2)写出下列物质的电子式:过氧化氢 氯化铵
(3)写出下列物质的结构式:HClO N2H4
(4)用电子式表示下列化合物的形成过程:
过氧化钠
二氧化碳 .
①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧I2 ⑨He
只含有离子键的是(用序号回答)
(2)写出下列物质的电子式:过氧化氢
(3)写出下列物质的结构式:HClO N2H4
(4)用电子式表示下列化合物的形成过程:
过氧化钠
二氧化碳
考点:离子化合物的结构特征与性质,电子式,用电子式表示简单的离子化合物和共价化合物的形成
专题:化学用语专题,化学键与晶体结构
分析:(1)一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,只含共价键的化合物是共价化合物,常温时为固体,当其熔化时,不破坏化学键说明该物质是分子晶体;
(2)过氧化氢中H原子和O原子之间存在极性键、O原子和O原子之间存在非极性键;氯化铵中铵根离子和氯离子之间存在离子键、N原子和H原子之间存在共价键;
(3)次氯酸分子中O原子和H原子、Cl原子之间都存在一对共用电子对,N2H4中的N原子可达到8电子的稳定结构,氮原子最外层3个电子形成三对共用电子对,和未成键的一对电子形成8电子稳定结构,每个氮原子和两个氢原子形成共价键,氮原子间形成一个共价键;
(4)O原子和Na原子之间通过得失电子形成离子化合物过氧化钠;
C原子和O原子通过共用电子对形成共价化合物二氧化碳.
(2)过氧化氢中H原子和O原子之间存在极性键、O原子和O原子之间存在非极性键;氯化铵中铵根离子和氯离子之间存在离子键、N原子和H原子之间存在共价键;
(3)次氯酸分子中O原子和H原子、Cl原子之间都存在一对共用电子对,N2H4中的N原子可达到8电子的稳定结构,氮原子最外层3个电子形成三对共用电子对,和未成键的一对电子形成8电子稳定结构,每个氮原子和两个氢原子形成共价键,氮原子间形成一个共价键;
(4)O原子和Na原子之间通过得失电子形成离子化合物过氧化钠;
C原子和O原子通过共用电子对形成共价化合物二氧化碳.
解答:
解:(1)只含有离子键的是①,含有共价键的离子化合物是③⑤⑥,含有共价键的共价化合物是②④⑦,常温时为固体,当其熔化时,不破坏化学键的是⑧,
故答案为:①;③⑤⑥;②④⑦;⑧;
(2)过氧化氢中H原子和O原子之间存在极性键、O原子和O原子之间存在非极性键,过氧化氢的电子式为 ;氯化铵中铵根离子和氯离子之间存在离子键、N原子和H原子之间存在共价键,其电子式为
;氯化铵中铵根离子和氯离子之间存在离子键、N原子和H原子之间存在共价键,其电子式为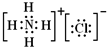 ,故答案为:
,故答案为: ;
;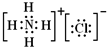 ;
;
(3)次氯酸分子中O原子和H原子、Cl原子之间都存在一对共用电子对,其结构式为H-O-Cl;N2H4中的N原子可达到8电子的稳定结构,氮原子最外层3个电子形成三对共用电子对,和未成键的一对电子形成8电子稳定结构,每个氮原子和两个氢原子形成共价键,氮原子间形成一个共价键,结构式为: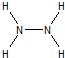 ,
,
故答案为:H-O-Cl; ;
;
(4)O原子和Na原子之间通过得失电子形成离子化合物过氧化钠,形成过程为 ;
;
二氧化碳是氧原子和碳原子之间通过共价键形成的共价化合物,形成过程为: ,
,
故答案为: ;
; ..
..
故答案为:①;③⑤⑥;②④⑦;⑧;
(2)过氧化氢中H原子和O原子之间存在极性键、O原子和O原子之间存在非极性键,过氧化氢的电子式为
 ;氯化铵中铵根离子和氯离子之间存在离子键、N原子和H原子之间存在共价键,其电子式为
;氯化铵中铵根离子和氯离子之间存在离子键、N原子和H原子之间存在共价键,其电子式为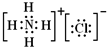 ,故答案为:
,故答案为: ;
;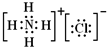 ;
;(3)次氯酸分子中O原子和H原子、Cl原子之间都存在一对共用电子对,其结构式为H-O-Cl;N2H4中的N原子可达到8电子的稳定结构,氮原子最外层3个电子形成三对共用电子对,和未成键的一对电子形成8电子稳定结构,每个氮原子和两个氢原子形成共价键,氮原子间形成一个共价键,结构式为:
 ,
,故答案为:H-O-Cl;
 ;
;(4)O原子和Na原子之间通过得失电子形成离子化合物过氧化钠,形成过程为
 ;
;二氧化碳是氧原子和碳原子之间通过共价键形成的共价化合物,形成过程为:
 ,
,故答案为:
 ;
; ..
..
点评:本题考查较综合,属于基础题,根据物质的构成微粒确定化学键,注意次氯酸结构式中中心原子是O原子而不是Cl原子,为易错点.

练习册系列答案
 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
下列关于浓硫酸是蔗糖脱水的实验的有关操作、现象、解释或结论的一些描述,其中不正确的是( )
| A、在蔗糖中加入浓硫酸之前先加少量的水 |
| B、浓硫酸遇水放热加速反应的进行 |
| C、产生大量具有刺激性气体 |
| D、整个实验中浓硫酸只体现出脱水性 |
生活中的一些问题常涉及到化学知识,则下列叙述不正确的是( )
| A、高温能杀死流感病毒是因为构成病毒的蛋白质受热变性 |
| B、明矾和漂白粉常用于自来水的净化,但两者的作用原理不相同 |
| C、氯化铁溶液可用于制作印刷电路板是因为其具有较强氧化性,能氧化单质铜 |
| D、“加碘食盐”、“含氟牙膏”、“富硒营养品”、“高钙牛奶”、“加铁酱油”等等,这里的碘、氟、硒指的是对应的单质分子,而钙、铁则分别指的是对应的钙离子和铁离子 |
下列各种情况下,溶液中可能大量存在的离子组是( )
| A、澄清透明的溶液中:K+、Fe2+、NO3-、MnO4- |
| B、使pH试纸呈红色的溶液中:I-、Cl-、ClO-、Na+ |
| C、含有较多的Al3+的溶液中:K+、Ca2+、HCO3-、Cl- |
| D、由水电离出的c(H+)=1×10-12mol/L的溶液中:K+、Na+、Cl-、NO3- |



 如图是制取溴苯的装置,试回答:
如图是制取溴苯的装置,试回答: