题目内容
3.海洋中有丰富的食品、矿产、能源、药物和水产资源等.如图,下列有关说法正确的是( )
| A. | 以NaCl为工业原料可以生产烧碱、纯碱以及漂白粉等含氯产品 | |
| B. | 工业上通过电解饱和MgCl2溶液制取金属镁 | |
| C. | 第③④⑤步的目的是浓缩、富集溴单质,这三步中溴元素均被氧化 | |
| D. | 过程①除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入的药品顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
分析 海水通过蒸发浓缩得到粗盐和母液,粗盐精制除去杂质得到精盐,电解饱和食盐水得到氢氧化钠、氯气和氢气,母液中含有镁离子和溴离子,加入石灰乳沉淀镁离子过滤得到氢氧化镁沉淀和滤液,氢氧化镁溶解后浓缩蒸发,冷却结晶,过滤洗涤,在氯化氢气流中加热失去结晶水得到无水氯化镁,滤液中加入氧化剂氯水氧化溴离子为溴单质,再通入二氧化硫吸收后,加入酸重新生成溴单质,
A.以氯化钠为原料,电解饱和食盐水生成氢氧化钠、氯气和氢气,属于氯碱工业,生产烧碱,生成的氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水是工业制备漂白粉的原理,氨化的饱和氯化钠溶液中通入二氧化碳生成碳酸氢钠和氯化铵,碳酸氢钠受热分解生成碳酸钠、属于纯碱工业制备,
B.电解饱和MgCl2溶液得到氢氧化镁、氢气和氯气;
C.溴元素失电子化合价升高时被氧化;
D.除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可以加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除钙离子和过量的钡离子,盐酸要放在最后,来除去过量的氢氧化钠和碳酸钠,加氢氧化钠和氯化钡无先后顺序要求.
解答 解:A.工业上以氯化钠为原料,电解饱和食盐水生成氢氧化钠、氯气和氢气,生产烧碱,生成的氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水是工业制备漂白粉的原理,向氨化的饱和氯化钠溶液中通入二氧化碳生成碳酸氢钠和氯化铵,碳酸氢钠受热分解生成碳酸钠,是侯德榜制碱属于纯碱工业制备,以NaCl为工业原料可以生产烧碱、纯碱以及漂白粉等含氯产品,故A正确;
B.镁为活泼金属,电解氯化镁溶液,在阳极生成氯气,在阴极生成氢气和氢氧化镁沉淀,不能得到镁,应用电解熔融氯化镁的方法冶炼,故B错误;
C.第③步中,溴元素化合价从-1升高到0价,被氧化,第④步中,溴元素化合价从0降低到-1价,被还原,第⑤步中,溴元素化合价从-1升高到0价,被氧化,故C错误;
D.选项中的试剂添加顺序中,钡离子最后无法除去,则加入的药品顺序为:BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸,故D错误;
故选A.
点评 本题考查了海水的利用,物质的提纯和分离方法、工业制备漂白粉、烧碱、纯碱的过程分析,利用所学知识结合框图信息是解答本题的关键,题目难度中等.

 轻松暑假总复习系列答案
轻松暑假总复习系列答案| A. | v(NH3)=0.02mol•(L•min)-1 | B. | v(NH3)=0.01mol•(L•min)-1 | ||
| C. | v(N2)=0.01mol•(L•min)-1 | D. | v(H2)=0.03mol•(L•min)-1 |
| A. | 氡气是双原子分子 | |
| B. | 氡气因其化学性质活泼而对人体有害 | |
| C. | 氡元素有222Rn、220Rn、219Rn三种同素异形体 | |
| D. | 氡的原子核外有6个电子层,最外层有8个电子 |
| A. | 改变压强不一定改变反应速率 | |
| B. | 使用催化剂能同时增大正、逆反应的速率,并改变化学反应的限度 | |
| C. | 固体物质的状态(如块状、粉末状等)对反应速率有影响 | |
| D. | 升高温度一定能增大反应速率 |

| A. | 凯库勒 | B. | 道尔顿 | C. | 拉瓦锡 | D. | 门捷列夫 |
| A. | 研究物质在水溶液中的反应,溶液是环境,盛溶液的烧杯和溶液之外的空气等便是体系 | |
| B. | 能源的开发和利用可以用来衡量一个国家或地区的经济发展和科学技术水平 | |
| C. | 催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加 | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1mol KOH的溶液混合,放出的热量大于57.3kJ |
| A. | 1mol乙酸和甲酸甲酯的混合物中含有共用电子对的数目是8×6.02×1023 | |
| B. | 等物质的量的-CH3与OH-所含电子数相等 | |
| C. | 7.8g Na2O2中所含阴离子的物质的量是0.2mol | |
| D. | 35C12和37C12互为同素异形体 |

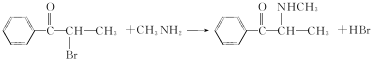 .A→B的反应类型为取代反应.
.A→B的反应类型为取代反应.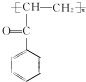 .
.
 的合成路线:
的合成路线: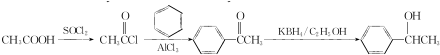 .
. 3-甲基-2-乙基-1,3-戊二烯
3-甲基-2-乙基-1,3-戊二烯  2,2-二甲基-1-丙醇
2,2-二甲基-1-丙醇 2-甲基-2-溴-3-庚烯或者2-溴-2-甲基-3-庚烯.
2-甲基-2-溴-3-庚烯或者2-溴-2-甲基-3-庚烯.