题目内容
15.下列说法正确的( )| A. | 1mol乙酸和甲酸甲酯的混合物中含有共用电子对的数目是8×6.02×1023 | |
| B. | 等物质的量的-CH3与OH-所含电子数相等 | |
| C. | 7.8g Na2O2中所含阴离子的物质的量是0.2mol | |
| D. | 35C12和37C12互为同素异形体 |
分析 A.乙酸和甲酸甲酯互为同分异构体,每个乙酸和甲酸甲酯分子中所含共用电子对个数都是8;
B.一个-CH3与OH-所含电子数分别是9、10;
C.1mol过氧化钠化中含有1mol阴离子;
D.同种元素的不同单质互称同素异形体.
解答 解:A.乙酸和甲酸甲酯互为同分异构体,每个乙酸(CH3COOH)和甲酸甲酯(HCOOCH3)分子中所含共用电子对个数都是8,所以1mol乙酸和甲酸甲酯的混合物中含有共用电子对的数目是8×6.02×1023,故A正确;
B.一个-CH3与OH-所含电子数分别是9、10,所以等物质的量的-CH3与OH-所含电子数不等,故B错误;
C.Na2O2是钠离子和过氧根离子构成的离子化合物,电子式为 ,1mol过氧化钠化中含有1mol阴离子过氧根离子,.7.8g Na2O2的物质的量是0.1mol,所以7.8g Na2O2中所含阴离子的物质的量是0.1mol,故C错误;
,1mol过氧化钠化中含有1mol阴离子过氧根离子,.7.8g Na2O2的物质的量是0.1mol,所以7.8g Na2O2中所含阴离子的物质的量是0.1mol,故C错误;
D.同种元素的不同单质互称同素异形体,35Cl2和37Cl2是同一种物质,故D错误;
故选A.
点评 本题考查较综合,涉及物质结构的计算、基本概念等知识点,明确物质的构成、成键情况、同素异形体概念等知识是解本题关键,过氧化钠阴阳离子个数比,为易错点,题目难度不大.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
5.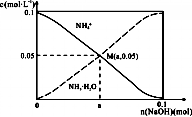 常温下,向1L0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
常温下,向1L0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
 常温下,向1L0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
常温下,向1L0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )| A. | M点溶液中水的电离程度比原溶液小 | |
| B. | 据电荷守恒可知在M点时,n(OH-)-n(H+)=(a-0.05)mol | |
| C. | 当n(NaOH)=0.1mol时,c(Na+)=c(NH4+)+c(NH3•H2O) | |
| D. | 随着NaOH的加入,$\frac{c({H}^{+})}{c(N{H}_{4}^{+})}$不断增大 |
3.海洋中有丰富的食品、矿产、能源、药物和水产资源等.如图,下列有关说法正确的是( )


| A. | 以NaCl为工业原料可以生产烧碱、纯碱以及漂白粉等含氯产品 | |
| B. | 工业上通过电解饱和MgCl2溶液制取金属镁 | |
| C. | 第③④⑤步的目的是浓缩、富集溴单质,这三步中溴元素均被氧化 | |
| D. | 过程①除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入的药品顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
10.对下列各组物质关系的描述中不正确的是( )
| A. | O2和O3互为同素异形体 | |
| B. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H和${\;}_{1}^{3}$H互为同位素 | |
| C. | CH2═CH2和 互为同系物 互为同系物 | |
| D. |  互为同分异构体 互为同分异构体 |
7.已知CoCln•mNH3可表示+3价Co的一种八面体配合物,若0.1mol配合物与足量AgNO3作用生成0.2mol AgCl沉淀,则m、n的值是( )
| A. | m=4,n=2 | B. | m=4,n=5 | C. | m=3,n=3 | D. | m=5,n=3 |
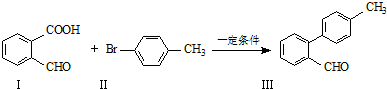
 ,水杨酸酯E为紫外吸收剂,可用于配制防晒霜.E的一种合成路线如下:
,水杨酸酯E为紫外吸收剂,可用于配制防晒霜.E的一种合成路线如下:
 ;
; :
:
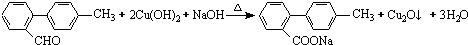 .
.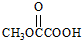 与
与  也可以发生类似反应①的反应,有机产物的结构简式为
也可以发生类似反应①的反应,有机产物的结构简式为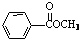 .
.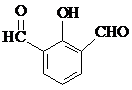 、
、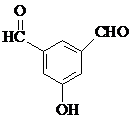 、
、 (要求:①能与FeCl3溶液发生显色反应;②苯环上一氯取代产物有2种)
(要求:①能与FeCl3溶液发生显色反应;②苯环上一氯取代产物有2种)