题目内容
11.200mL某硫酸盐溶液中,含硫酸根离子1.5NA个,含金属离子NA个,则该硫酸盐溶液的物质的量浓度为( )| A. | 2.5mol/L | B. | 5mol/L | C. | 7.5mol/L | D. | 2mol/L |
分析 含硫酸根离子1.5NA个,含金属离子NA个,则金属离子与硫酸根离子个数比为NA:1.5NA=2:3,硫酸盐可表示为M2(SO4)3,结合c=$\frac{n}{V}$计算.
解答 解:含硫酸根离子1.5NA个,含金属离子NA个,则金属离子与硫酸根离子个数比为NA:1.5NA=2:3,硫酸盐可表示为M2(SO4)3,
n(M3+)=$\frac{{N}_{A}}{{N}_{A}}$=1mol,则n[M2(SO4)3]=0.5mol,该硫酸盐溶液的物质的量浓度为$\frac{0.5mol}{0.2L}$=2.5mol/L,
故选A.
点评 本题考查物质的量浓度的计算,为高频考点,把握物质构成、物质的量与浓度的关系为解答的关键,侧重分析与计算能力的考查,注意硫酸盐的确定,题目难度不大.

练习册系列答案
相关题目
1.有时候,将氧化还原反应方程式拆开写成两个“半反应”.下面是一个“半反应”式:MnO4-+____H++____e---____Mn2++____H2O
该反应方程式的配平化学计量数是( )
该反应方程式的配平化学计量数是( )
| A. | 1,8,4,1,4 | B. | 2,16,5,2,8 | C. | 1,6,5,1,3 | D. | 1,8,5,1,4 |
19.物质的量相等的一氧化氮和二氧化氮相比较,下列有关叙述中正确的是( )
①它们所含的分子数目之比为1:1
②它们所含的氧原子数目之比为2:1
③它们所含的原子总数目之比为2:3
④它们所含的氮原子数目之比为1:1.
①它们所含的分子数目之比为1:1
②它们所含的氧原子数目之比为2:1
③它们所含的原子总数目之比为2:3
④它们所含的氮原子数目之比为1:1.
| A. | ①④ | B. | ①②③ | C. | ②③④ | D. | ①③④ |
16. 已知:还原性HSO3->I-,氧化性IO3->I2.在含3molNaHSO3的溶液中逐滴加入NaIO3溶液.加入NaIO3的物质的量和析出的I2的物质的量的关系曲线如图所示.下列说法正确的是( )
已知:还原性HSO3->I-,氧化性IO3->I2.在含3molNaHSO3的溶液中逐滴加入NaIO3溶液.加入NaIO3的物质的量和析出的I2的物质的量的关系曲线如图所示.下列说法正确的是( )
 已知:还原性HSO3->I-,氧化性IO3->I2.在含3molNaHSO3的溶液中逐滴加入NaIO3溶液.加入NaIO3的物质的量和析出的I2的物质的量的关系曲线如图所示.下列说法正确的是( )
已知:还原性HSO3->I-,氧化性IO3->I2.在含3molNaHSO3的溶液中逐滴加入NaIO3溶液.加入NaIO3的物质的量和析出的I2的物质的量的关系曲线如图所示.下列说法正确的是( )| A. | 反应过程中的氧化产物均为Na2HSO4 | |
| B. | a点时剩余NaHSO3的物质的量为1.0 mol | |
| C. | 0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-+3OH-=3SO43-+I-+3H2O | |
| D. | 当溶液中I-与I2的物质的量之比为5:3时,加入的NaIO3为1.1mol |
3.下列说法正确的是( )
| A. | 可用 和HCHO 为原料合成 和HCHO 为原料合成  | |
| B. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| C. | C3H8的六氯代物共有4种,而且CH3-CH=CH-CH3与C3H6一定互为同系物 | |
| D. | 将0.1 mol/L的NaOH溶液与0.5 mol/L的CuSO4溶液等体积混合制得氢氧化铜悬浊液,用于检验麦芽糖是还原糖 |
1.下列变化中,不可能通过一步反应实现的是( )
| A. | SiO2→Na2SiO3 | B. | SiO 2→H 2SiO 3 | C. | CuSO 4→CuCl 2 | D. | Cu(OH)2→CuO |




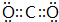 ,BA2分子中化学键属于共价键.
,BA2分子中化学键属于共价键.