题目内容
13.现有物质:①Cu、②CO2、③稀硫酸、④Ba(OH)2溶液、⑤稀硝酸、⑥熔融的Na2CO3(1)上述物质中,非电解质是②(填物质代号),能导电的电解质是⑥(填代号),
(2)④在水中的电离方程式为Ba(OH)2=Ba2++2OH-.
(3)实验室欲配制240mL 0.2mol/L ⑥的溶液,所用到的主要仪器有天平、烧杯、玻璃棒、250mL容量瓶、胶头滴管,应称取Na2CO3固体的质量为5.3g,
下列操作会造成所配溶液实际浓度偏高的是ac(填字母代号).
a.定容时俯视容量瓶的刻线 b.容量瓶用蒸馏水洗涤后未干燥
c.未冷却就将溶液转移至容量瓶 d.移液后未用蒸馏水洗涤玻璃棒和烧杯
(4)①和⑤在常温下反应的方程式为:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O.该反应中当有6.4gCu被氧化时,氧化剂得到电子的物质的量为0.2mol.
(5)常温下将少量①放入③中,无明显现象,若持续通入O2,可观察到①溶解,溶液变蓝,通入O2后发生反应的化学方程式为2Cu+O2+2H2SO4=2CuSO4+2H2O.
分析 (1)非电解质、电解质均为化合物,非电解质在水中和熔融均不导电,含自由电子或离子的均可导电;
(2)Ba(OH)2为强碱,完全电离;
(3)因配制溶液的体积为240mL,而容量瓶的规格没有240mL,只能选用250mL,结合n=vc、m=nM计算,c=$\frac{n}{V}$分析操作对溶质的物质的量或对溶液的体积的影响判断;
(4)由电子守恒可知,Cu失去电子等于氧化剂得到电子;
(5)观察到①溶解,溶液变蓝,则生成硫酸铜.
解答 解:(1)非电解质、电解质均为化合物,非电解质在水中和熔融均不导电,则只有②为非电解质;含自由电子或离子的均可导电,则能导电的电解质为⑥,
故答案为:②;⑥;
(2)Ba(OH)2为强碱,完全电离,电离方程式为Ba(OH)2=Ba2++2OH-,故答案为:Ba(OH)2=Ba2++2OH-;
(3)因配制溶液的体积为240mL,而容量瓶的规格没有240mL,只能选用250mL,Na2CO3的物质的量n=cV=0.25L×0.2mol•L-1=0.05mol,其质量为0.05mol×106g/mol=5.3g,配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管,
a.定容时俯视容量瓶的刻线,水加少了,体积偏小,由c=$\frac{n}{V}$可知,浓度偏高,故选;
b.容量瓶用蒸馏水洗涤后未干燥,n、V均不变,则浓度不变,故B不选;
c.未冷却就将溶液转移至容量瓶,水加少了,体积偏小,由c=$\frac{n}{V}$可知,浓度偏高,故选;
d.移液后未用蒸馏水洗涤玻璃棒和烧杯,n少了,由c=$\frac{n}{V}$可知,浓度偏偏低,故不选;
故答案为:250mL容量瓶;胶头滴管;5.3g;ac;
(4)由电子守恒可知,Cu失去电子等于氧化剂得到电子,则当有6.4gCu被氧化时,氧化剂得到电子的物质的量为$\frac{6.4g}{64g/mol}$×(2-0)=0.2mol,故答案为:0.2mol;
(5)观察到①溶解,溶液变蓝,则生成硫酸铜,则通入O2后发生反应的化学方程式为2Cu+O2+2H2SO4=2CuSO4+2H2O,故答案为:2Cu+O2+2H2SO4=2CuSO4+2H2O.
点评 本题考查较综合,涉及电解质、氧化还原反应及离子反应,为高频考点,把握发生的反应、反应中元素的化合价变化是解答本题的关键,侧重分析与应用能力的考查,题目难度不大.

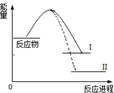
| A. | 1molN≡N键能与3molH-H键能之和大于6molN-H键能,所以反应为放热 | |
| B. | N2(g)+3H2(g)?2NH3(l)+Q2反应历程的能量变化如曲线Ⅱ,则Q2>Q1 | |
| C. | 选择合适的催化剂,可以降低反应所需温度,Q1值也相应减少 | |
| D. | 2mol氨气的能量高于1mol氮气和3mol氢气的能量之和,所以反应需要高温 |
| A. | 聚丙烯的结构简式: | B. | NH4Br的电子式: | ||
| C. | 对羟基苯甲醛的结构简式: | D. | 二氧化碳分子的比例模型: |
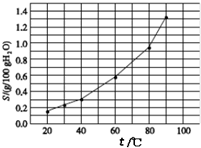
| A. | 温度升高不利于溴酸银的溶解 | |
| B. | 溴酸银的溶解是放热过程 | |
| C. | 若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 | |
| D. | 60℃时,将0.04g溴酸银加入到10g水中,形成的分散系中存在沉淀溶解平衡 |
| A. | 氯气起杀菌消毒作用 | B. | 氯气氧化绿矾 | ||
| C. | 绿矾具有净水作用 | D. | 绿矾的氧化产物具有净水作用 |
