题目内容
14.离子晶体之间的决定于离子键的大小,下列按离子键由大到小排列的是( )| A. | NaF>NaCl>NaBr>NaI | B. | Na20>Na2S>NaCl>NaI | ||
| C. | NaCl>CaCl2>MgCl2>AlCl3 | D. | MgCO3>CaCO3>SrCO3>BaCO3 |
分析 离子半径越小,离子电荷越大,则离子键越大,以此来解答.
解答 解:A.F、Cl、Br、I的离子半径增大,则离子键为NaF>NaCl>NaBr>NaI,故A正确;
B.离子半径Cl-<S2-,则离子键为NaCl>Na2S,故B错误;
C.电荷越大离子键越大,则离子键为MgCl2>CaCl2>NaCl,故C错误;
D.Mg、Ca、Sr、Ba的离子半径增大,则离子键为MgCO3>CaCO3>SrCO3>BaCO3,故D正确;
故选AD.
点评 本题考查离子键的判断,为高频考点,把握离子半径、离子电荷与离子键的关系为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案
相关题目
2.下列有关化学反应的判断不正确的是( )
| A. | BaC03(s)=BaO(s)+CO2(g)在高温下能自发进行,推知△H>0 | |
| B. | 2CO(g)=2C(s)+O2(g)是吸热反应,推知该反应在低温下能自发进行 | |
| C. | 4NH3(g)+5O2(g)=4N0(g)+6H2O(g)是放热反应,推知该反应能自迸行 | |
| D. | N2(g)+3H2(g)=2NH3(g)是熵减的放热反应,推知该反应在低温下能自迸行,但在实际生产中,为了保证反应速率,常采用高温、高压、催化剂等条件 |
9.下列说法错误的是( )
| A. | 非金属元素的两原子之间不可能形成离子键 | |
| B. | 离子化合物不可能全部由非金属元素组成 | |
| C. | 含有非极性键的分子不一定是共价化合物 | |
| D. | 离子化合物中一定含有离子键. |
19.如某地发生氨气泄漏事件,居民们要立即转移,假如你在现场,你会采用以下什么方法?( )
| A. | 向上风口转移 | B. | 向下风口转移 | ||
| C. | 用湿毛巾捂住口鼻 | D. | 及时戴上用硫酸溶液湿润过的口罩 |
6.物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当它们的体积比为1:2:3时,三种溶液中Cl-的物质的量之比为( )
| A. | 3:4:3 | B. | 1:2:3 | C. | 3:2:1 | D. | 1:4:9 |
7.单斜硫和正交硫是硫的两种同素异形体
已知:①S(单斜,s)+O2(g)═SO2(g)△H1=-297.16kJ•mol-1
②S(正交,s)+O2(g)═SO2(g)△H2=-296.83kJ•mol-1
③S(单斜,s)═S(正交,s)△H3
下列说法正确的是( )
已知:①S(单斜,s)+O2(g)═SO2(g)△H1=-297.16kJ•mol-1
②S(正交,s)+O2(g)═SO2(g)△H2=-296.83kJ•mol-1
③S(单斜,s)═S(正交,s)△H3
下列说法正确的是( )
| A. | △H3=+0.33 kJ•mol-1 | |
| B. | 单斜硫转化为正交硫的反应是吸热反应 | |
| C. | △H3<0,正交硫比单斜硫稳定 | |
| D. | △H3>0,单斜硫比正交硫稳定 |
 (注:R、R′为径基).A为有机合成中间体,可发生银镜反应.A在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品.A能发生如图所示的变化.
(注:R、R′为径基).A为有机合成中间体,可发生银镜反应.A在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品.A能发生如图所示的变化.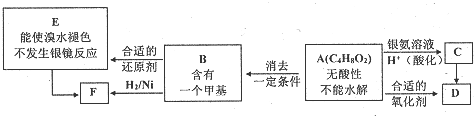
 或
或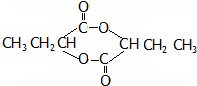 .
. .
.