题目内容
2.常温下,0.05mol/L H2SO4溶液的pH为多少?0.1mo1/L NaOH溶液的pH为多少?pH=2的H2SO4溶液中c(H+)是多少?c(H2SO4)是多少?分析 硫酸和NaOH都是强电解质,在水溶液中完全电离,0.05mol/L硫酸溶液中c(H+)=2c( H2SO4),c(OH-)=c(NaOH)=0.1mol/L,该溶液中c(H+)=$\frac{1{0}^{-14}}{0.1}$mol/L=10-13 mol/L,pH=-lgc(H+),c(H+)=10-pH,据此分析解答.
解答 解:硫酸和NaOH都是强电解质,在水溶液中完全电离,0.05mol/L硫酸溶液中c(H+)=2c( H2SO4)=0.1mol/L,pH=-lgc(H+)=-lg0.1=1,c(OH-)=c(NaOH)=0.1mol/L,该溶液中c(H+)=$\frac{1{0}^{-14}}{0.1}$mol/L=10-13 mol/L,pH=-lgc(H+)=-lg10-13=13;pH=2的硫酸中c(H+)=10-pH mol/L=10-2 mol/L=0.01mol/L,该溶液中c(H2SO4)=$\frac{1}{2}$×c(H+)=$\frac{1}{2}$×0.01mol/L=0.005mol/L,
答:常温下,0.05mol/L H2SO4溶液的pH为1;0.1mo1/L NaOH溶液的pH为13;pH=2的H2SO4溶液中c(H+)是0.01mol/L,c(H2SO4)是0.005mol/L.
点评 本题考查pH的有关计算,为高频考点,明确化学式与离子关系是解本题关键,知道溶液中氢离子浓度与pH关系,题目难度不大.

练习册系列答案
相关题目
17.下列铝及其化合物的性质和应用的说法正确的是( )
| A. | 铝箔插入稀HNO3中,无现象,说明铝箔表面被HNO3氧化,形成致密的氧化膜 | |
| B. | 加入铝粉能产生H2的溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3- | |
| C. | 明矾可用于水的消毒,杀菌 | |
| D. | 向NaAlO2溶液中通入过量CO2的离子方程式为2AlO${\;}_{2}^{-}$+CO2+3H2O═2Al(OH)3↓+CO${\;}_{3}^{2-}$ |
10.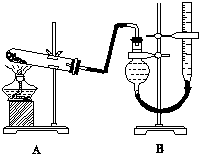 某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
(一)制取氧化铜
①称取2g CuSO4•5H2O研细后倒入烧杯,加10mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用.
回答下列问题:
(1)上述实验步骤中需要使用玻璃棒的是①②③(填实验序号),步骤①③中研磨固体所用仪器的名称是研钵;
(二)证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较,相关数据如下:
回答下列问题:
(2)上述实验中“待测数据”指产生25mL气体所需时间;
(3)本实验装置图中量气装置B由干燥管、乳胶管和50mL滴定管改造后组装而成,此处所用滴定管是碱式(选填“酸式”或“碱式”)滴定管;读数时需要注意①上下移动右管使两液面相平; ②视线与刻度线相平
(4)为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a.检测CuO反应前后质量是否改变,
b.CuO的化学性质有没有改变.
 某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:(一)制取氧化铜
①称取2g CuSO4•5H2O研细后倒入烧杯,加10mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用.
回答下列问题:
(1)上述实验步骤中需要使用玻璃棒的是①②③(填实验序号),步骤①③中研磨固体所用仪器的名称是研钵;
(二)证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较,相关数据如下:
| 实验序号 | KClO3质量 | 其他物质质量 | 待测数据 |
| ④ | 1.2g | 无其他物质 | |
| ⑤[ | 1.2g | CuO 0.5g | |
| ⑥ | 1.2g | MnO2 0.5g |
(2)上述实验中“待测数据”指产生25mL气体所需时间;
(3)本实验装置图中量气装置B由干燥管、乳胶管和50mL滴定管改造后组装而成,此处所用滴定管是碱式(选填“酸式”或“碱式”)滴定管;读数时需要注意①上下移动右管使两液面相平; ②视线与刻度线相平
(4)为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a.检测CuO反应前后质量是否改变,
b.CuO的化学性质有没有改变.



