题目内容
7.已知:PCl5(g)?PCl3(g)+Cl2(g).(1 )写出此反应的化学平衡常数表达式;
(2)已知某温度下,在容器为10L的密闭容器中充入1.10mol PCl5,达平衡后,测得容器内PCl3的浓度为0.1mol/L.计算此温度下的化学平衡常数;
(3)在上述温度下,在容器为2L的密闭容器中充入4mol PCl5.计算达到平衡时PCl5的分解率.
分析 (1)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
(2)在容器为10L的密闭容器中充入1.10mol PCl5,达平衡后,测得容器内PCl3的浓度为0.1mol/L,则:
PCl5(g)?PCl3(g)+Cl2(g)
起始浓度(mol/l):0.11 0 0
变化浓度(mol/L):0.1 0.1 0.1
平衡浓度(mol/L):0.01 0.1 0.1
代入平衡常数表达式K=$\frac{c(PC{l}_{3})×c(C{l}_{2})}{c(PC{l}_{5})}$计算;
(3)温度相同,平衡常数相同,设平衡时 PCl5的浓度变化量为xmol/L,表示出平衡常数各组分浓度,代入平衡常数表达式列方程计算解答.
解答 解:(1)PCl5(g)?PCl3(g)+Cl2(g)的平衡常数表达式K=$\frac{c(PC{l}_{3})×c(C{l}_{2})}{c(PC{l}_{5})}$,
答:PCl5(g)?PCl3(g)+Cl2(g)的平衡常数表达式为$\frac{c(PC{l}_{3})×c(C{l}_{2})}{c(PC{l}_{5})}$.
(2)在容器为10L的密闭容器中充入1.10mol PCl5,达平衡后,测得容器内PCl3的浓度为0.1mol/L,则:
PCl5(g)?PCl3(g)+Cl2(g)
起始浓度(mol/l):0.11 0 0
变化浓度(mol/L):0.1 0.1 0.1
平衡浓度(mol/L):0.01 0.1 0.1
平衡常数K=$\frac{c(PC{l}_{3})×c(C{l}_{2})}{c(PC{l}_{5})}$=$\frac{0.1×0.1}{0.01}$=1,
答:该温度下平衡常数为1;
(3)温度相同,平衡常数相同,设平衡时 PCl5的浓度变化量为xmol/L,则:
PCl5(g)?PCl3(g)+Cl2(g)
起始浓度(mol/l):2 0 0
变化浓度(mol/L):x x x
平衡浓度(mol/L):2-x x x
则$\frac{x×x}{2-x}$=1,解得x=1
达到平衡时PCl5的分解率为$\frac{1mol/L}{2mol/L}$×100%=50%,
答:达到平衡时PCl5的分解率为50%.
点评 本题考查化学平衡计算,难度不大,注意三段式解题法在化学平衡计算中应用,注意掌握平衡常数的应用.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | $\frac{3{V}_{1}-{V}_{2}}{{V}_{1}+{V}_{2}}$ | |
| B. | $\frac{({V}_{1}+{V}_{2})×1{0}^{-14}}{{V}_{2}-3{V}_{1}}$ | |
| C. | $\frac{({V}_{1}{P}_{1}+{V}_{2}{P}_{2})×1{0}^{-14}}{({V}_{2}-3{V}_{1}){P}_{3}}$ | |
| D. | $\frac{({V}_{1}{P}_{1}+{V}_{2}{P}_{2})×1{0}^{-14}}{(3{V}_{1}-{V}_{2}){P}_{3}}$ |
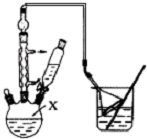 对叔丁基苯酚(
对叔丁基苯酚(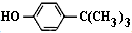 )工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯等为原料制备对叔丁基苯酚.
)工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯等为原料制备对叔丁基苯酚. .
. 开发新能源,使用清洁燃料,可以达到减少污染的目的.
开发新能源,使用清洁燃料,可以达到减少污染的目的.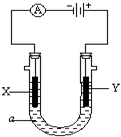 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.