题目内容
10.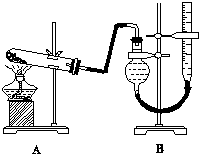 某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:(一)制取氧化铜
①称取2g CuSO4•5H2O研细后倒入烧杯,加10mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用.
回答下列问题:
(1)上述实验步骤中需要使用玻璃棒的是①②③(填实验序号),步骤①③中研磨固体所用仪器的名称是研钵;
(二)证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较,相关数据如下:
| 实验序号 | KClO3质量 | 其他物质质量 | 待测数据 |
| ④ | 1.2g | 无其他物质 | |
| ⑤[ | 1.2g | CuO 0.5g | |
| ⑥ | 1.2g | MnO2 0.5g |
(2)上述实验中“待测数据”指产生25mL气体所需时间;
(3)本实验装置图中量气装置B由干燥管、乳胶管和50mL滴定管改造后组装而成,此处所用滴定管是碱式(选填“酸式”或“碱式”)滴定管;读数时需要注意①上下移动右管使两液面相平; ②视线与刻度线相平
(4)为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a.检测CuO反应前后质量是否改变,
b.CuO的化学性质有没有改变.
分析 (1)玻璃棒是实验中常用的仪器,作用有:1搅拌2转移固体3引流4、蘸取少许溶液.将固体药品研磨或研碎实验室常用的仪器为研钵;
(2)实验的目的是:证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较,上述实验中已有数据KClO3质量和其它物质质量,要比较催化效果就是看使用氧化铜与二氧化锰哪一种产生相同体积气体时所需时间短,或在相同时间内,哪一种物质产生的气体多;
(3)碱式滴定管的构造为:橡胶管、玻璃珠.酸式滴定管的构造为连在玻璃管上的玻璃活塞,计数时为了保证气体的压强与大气压强相等,需要保持两液面在同水平面内,再读数;
(4)催化剂的特点是:能改变其他物质的化学反应速率,而本身的质量和化学性质在化学反应前后都没有发生改变.
解答 解:(1)①用蒸馏水溶解2gCuSO4•5H2O,需要使用玻璃棒搅拌,加快CuSO4•5H2O在水中的溶解速率;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物转移到蒸发皿,需要使用玻璃棒,转移沉淀物Cu(OH)2;加热至沉淀Cu(OH)2全部分解变为黑色CuO,需要使用玻璃棒搅拌,目的使潮湿的沉淀Cu(OH)2受热均匀,防止因受热不均匀而飞溅;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用.过滤时需要使用玻璃棒引流防止溶液外洒,过滤出来的沉淀物洗涤,不能用玻璃棒搅拌,因沉淀物也有溶解度,如果用玻璃棒搅拌,沉淀会损失比较多.研钵是实验中研碎固体药品或进行粉末状固体的混和的仪器,该题中研碎黑色CuO用研钵,
故答案为:①②③;研钵;
(2)本题④⑤⑥三次实验,提供的KClO3质量均为1.2g,实验④的作用为:在不加催化剂的条件下产生氧气的速度与⑤加CuO 0.5g以及和⑥加MnO2 0.5g的效果作对照.⑤⑥加等质量不同的催化剂比较催化效果.比较催化效果方法一:看产生相同体积气体哪组所需时间短,方法二相同时间内,哪一组产生的气体多.该题题干要求:实验时均以生成25mL气体为准,故答案为:产生25mL气体所需时间;
(3)本实验装置图中用50mL滴定管改造组装成量气装置,对照酸式、碱式滴定管的构造,碱式滴定管的构造符合要求.可通过上下移动右管使两液面相平,并保证视线与刻度线相平再读数,故答案为:碱式;上下移动右管使两液面相平;
(4)探究CuO在实验⑤中是否起催化作用,根据催化剂的性质,从它的质量和化学性质角度探究,故答案为:检测CuO反应前后质量是否改变.
点评 本题综合性较强,需要理清催化剂的概念、掌握铜及其氧化物的性质进行解答.

 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案| A. | $\frac{3{V}_{1}-{V}_{2}}{{V}_{1}+{V}_{2}}$ | |
| B. | $\frac{({V}_{1}+{V}_{2})×1{0}^{-14}}{{V}_{2}-3{V}_{1}}$ | |
| C. | $\frac{({V}_{1}{P}_{1}+{V}_{2}{P}_{2})×1{0}^{-14}}{({V}_{2}-3{V}_{1}){P}_{3}}$ | |
| D. | $\frac{({V}_{1}{P}_{1}+{V}_{2}{P}_{2})×1{0}^{-14}}{(3{V}_{1}-{V}_{2}){P}_{3}}$ |
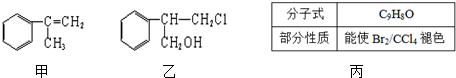
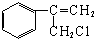 $→_{Ⅱ}^{一定条件}$Y$→_{Ⅲ}^{一定条件}$乙
$→_{Ⅱ}^{一定条件}$Y$→_{Ⅲ}^{一定条件}$乙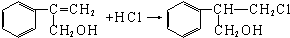 _(不需注明反应条件).
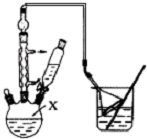
_(不需注明反应条件).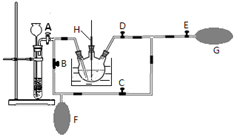 高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:
高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:
 对叔丁基苯酚(
对叔丁基苯酚(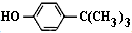 )工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯等为原料制备对叔丁基苯酚.
)工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯等为原料制备对叔丁基苯酚. .
.