题目内容
14.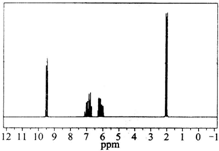 质谱图表明某有机物的相对分子质量为70,红外光谱表征到C═C和C═O的存在,1H核磁共振谱如图(峰面积之比依次为1:1:1:3):
质谱图表明某有机物的相对分子质量为70,红外光谱表征到C═C和C═O的存在,1H核磁共振谱如图(峰面积之比依次为1:1:1:3):分析核磁共振谱图,回答下列问题:
(1)分子中共有4种化学环境不同的氢原子.
(2)该物质的分子式为C4H6O.
(3)该有机物的结构简式为CH3CH=CHCHO.
分析 红外光谱表征到C═C和C═O的存在,相对分子质量为70,中含有1个C═C和1个C═O,去掉1个C═C和1个C═O的式量后剩余式量为70-36-16=18,应含有1个C原子、6个H原子,故该有机物分子式为C4H6O,1H核磁共振谱峰面积之比依次为1:1:1:3,则有4种H原子,不同H原子数目分别为1、1、1、3.
解答 解:(1)1H核磁共振谱有4个吸收峰,则分子中共有4种化学环境不同的氢原子,故答案为:4;
(2)红外光谱表征到C═C和C═O的存在,相对分子质量为70,中含有1个C═C和1个C═O,去掉1个C═C和1个C═O的式量后剩余式量为70-36-16=18,应含有1个C原子、6个H原子,故该有机物分子式为C4H6O,故答案为:C4H6O;
(3)1H核磁共振谱峰面积之比依次为1:1:1:3,则有4种H原子,不同H原子数目分别为1、1、1、3,则该有机物结构简式为:CH3CH=CHCHO,故答案为:CH3CH=CHCHO.
点评 本题考查有机物结构的推断、核磁共振氢谱、红外光谱等,侧重考查学生分析推理能力,(2)中注意利用残余法进行分子式确定,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.总压强为30Mpa时,氮气﹑氢气混合气体(体积比为1:3)通入合成塔,反应达平衡时,压强降为25Mpa则平衡时混合气体中氨气的体积分数为( )
| A. | 25% | B. | 20% | C. | 35% | D. | 30% |
2. 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.该反应为吸热反应(选填“吸热”、“放热”).
(2)能判断该反应是否已达化学平衡状态的依据是bc.
a.容器中压强不变b.混合气体中c(CO)不变c.v正(H2)=v逆(H2O)d.c(CO2)=c(CO)
(3)若 830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数K等于1.0(选填“大于”、“小于”、“等于”)
(4)某温度下,在2L的密闭容器中,加入1molCO2和1molH2充分反应达平衡时,CO平衡浓度为0.25mol/L,试判断此时的温度为830℃.
(5)若在(4)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,H2的物质的量为1.8mol.
 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(2)能判断该反应是否已达化学平衡状态的依据是bc.
a.容器中压强不变b.混合气体中c(CO)不变c.v正(H2)=v逆(H2O)d.c(CO2)=c(CO)
(3)若 830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数K等于1.0(选填“大于”、“小于”、“等于”)
(4)某温度下,在2L的密闭容器中,加入1molCO2和1molH2充分反应达平衡时,CO平衡浓度为0.25mol/L,试判断此时的温度为830℃.
(5)若在(4)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,H2的物质的量为1.8mol.
9.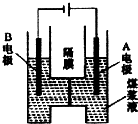 用惰性电极电解煤浆液的方法制H2的反应为C(s)+2H2O(l)=CO2(g)+2H2(g).现将一定量的1mol/LH2SO4溶液和适量煤粉充分混合,制成含碳量为0.02g/mL~0.12g/mL的煤浆液,置于如图所示装置中进行电解(两电极均为惰性电极).下列说法错误的是( )
用惰性电极电解煤浆液的方法制H2的反应为C(s)+2H2O(l)=CO2(g)+2H2(g).现将一定量的1mol/LH2SO4溶液和适量煤粉充分混合,制成含碳量为0.02g/mL~0.12g/mL的煤浆液,置于如图所示装置中进行电解(两电极均为惰性电极).下列说法错误的是( )
 用惰性电极电解煤浆液的方法制H2的反应为C(s)+2H2O(l)=CO2(g)+2H2(g).现将一定量的1mol/LH2SO4溶液和适量煤粉充分混合,制成含碳量为0.02g/mL~0.12g/mL的煤浆液,置于如图所示装置中进行电解(两电极均为惰性电极).下列说法错误的是( )
用惰性电极电解煤浆液的方法制H2的反应为C(s)+2H2O(l)=CO2(g)+2H2(g).现将一定量的1mol/LH2SO4溶液和适量煤粉充分混合,制成含碳量为0.02g/mL~0.12g/mL的煤浆液,置于如图所示装置中进行电解(两电极均为惰性电极).下列说法错误的是( )| A. | A极是阳极,B极为阴极 | |
| B. | A极的电极反应式为C+2H2O-4e-=CO2↑+4H+ | |
| C. | B极的电极反应式为2H++2e-=H2↑ | |
| D. | 电解一段时间后,煤浆液的pH增大 |
19.用铁粉与稀硫酸反应制取氢气时,下列措施能使氢气生成速率加快的是( )
| A. | 增加稀硫酸用量 | B. | 加几滴硫酸铜溶液 | ||
| C. | 用浓硫酸代替稀硫酸 | D. | 用铁片代替铁粉 |
6.下列关于钠及其化合物的叙述正确的是( )
| A. | Na在空气中久置最终变为过氧化钠 | |
| B. | 金属钠着火后应立即用泡沫灭火器灭火 | |
| C. | Na2O和Na2O2都是碱性氧化物 | |
| D. | Na2CO3叫纯碱,但属于盐类 |
3. T℃下的溶液中,c(H+)=10-xmol•L-1,c(OH-)=10-ymol•L-1,x与y的关系如图所示.下列说
T℃下的溶液中,c(H+)=10-xmol•L-1,c(OH-)=10-ymol•L-1,x与y的关系如图所示.下列说
法正确的是( )
 T℃下的溶液中,c(H+)=10-xmol•L-1,c(OH-)=10-ymol•L-1,x与y的关系如图所示.下列说
T℃下的溶液中,c(H+)=10-xmol•L-1,c(OH-)=10-ymol•L-1,x与y的关系如图所示.下列说法正确的是( )
| A. | T℃下,只有在纯水中才有c(H+)•c(OH-)=10-13 | |
| B. | 图中直线上的任意点都显中性 | |
| C. | T℃时,pH=7的溶液显碱性 | |
| D. | T℃时,pH=12的苛性钠溶液与pH=1的稀硫酸等体积混合,溶液的pH=7 |
4.下列离子方程式正确的是( )
| A. | 硫酸镁溶液跟氢氧化钡溶液反应:SO${\;}_{4}^{2-}$+Ba2+═BaSO4↓ | |
| B. | 过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO${\;}_{4}^{2-}$═BaSO4↓+2H2O | |
| C. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| D. | 澄清石灰水中加入盐酸:Ca(OH)2+2H+═Ca2++2H2O |
