题目内容
7.在元素周期表中位于金属元素和非金属元素交界处最容易找到的材料是( )| A. | 制催化剂的材料 | B. | 耐高温、耐腐蚀的合金材料 | ||
| C. | 半导体材料 | D. | 制农药的材料 |
分析 在金属元素与非金属元素的分界线附近的元素,通常既具有金属性又具有非金属性,可以找到半导体材料.
解答 解:A.可以用于做催化剂的元素种类较多,一般为过渡金属元素,故A错误;
B.耐高温、耐腐蚀的合金材料为金属材料,一般具有较强的金属性,大多属于过渡金属元素,故B错误;
C.在金属元素和非金属元素交接区域的元素通常既具有金属性又具有非金属性,可以用来做良好的半导体材料,如硅等,故C正确;
D.非金属元素位于右上方,非金属可以制备有机溶剂,部分有机溶剂可以用来做农药,故D错误;
故选C.
点评 本题考查元素周期表的结构和应用,为高频考点,本题根据元素周期表中的元素分布及元素常见的性质来解题,题目难度不大.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
20.下列实验操作或装置不符合实验要求的是( )
| 选项 | A | B | C | D |
| 操作 | 从CCl4萃取溴水中溴后的混合液中分离 | 二氧化锰与浓盐酸反应制干燥氯气 | 可用于制备并观察氢氧化铁沉淀 | 检查装置气密性 |
| 实验装置 | 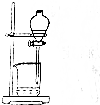 | 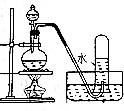 | 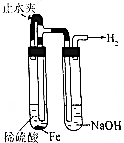 | 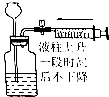 |
| A. | A | B. | B | C. | C | D. | D |
15.化学是21世纪最富有创造性的中心学科•下列有关说法不正确的是( )
| A. | 按照规定对生活废弃物进行分类放置,实现资源再利用 | |
| B. | 防治环境污染、开发智能软件、合成新材料等,都属于化学研究的领域 | |
| C. | 利用人工光合成反应,将二氧化碳转化为碳氢化合物作燃料,属于低碳技术 | |
| D. | 液晶态介于晶体状态和液态之间,液晶具有有一定程度的晶体的有序性和液体的流动性 |
12.下表是元素周期表的一部分,对于表中元素①~⑧,填空回答:
(1)地壳中含量最多的元素是O,非金属性最强的元素是F.
(2)写出①的最简单的气态氢化物的电子式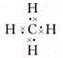 .
.
(3)在第三周期主族元素中,单质氧化性最强的是氯气,能形成的二元强酸是H2SO4.
(4)写出②的气态氢化物与②的最高价氧化物对应水化物反应的化学方程式NH3+HNO3=NH4NO3.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ |
(2)写出①的最简单的气态氢化物的电子式
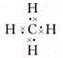 .
.(3)在第三周期主族元素中,单质氧化性最强的是氯气,能形成的二元强酸是H2SO4.
(4)写出②的气态氢化物与②的最高价氧化物对应水化物反应的化学方程式NH3+HNO3=NH4NO3.
19.一定量的混合气体在密闭容器中发生如下反应:mA(g)+nB(g)?pC(g),在一定温度下反应达到平衡,将容器容积缩小到原来的$\frac{1}{2}$,当达到新的平衡时,C的浓度变为原平衡时的1.9倍.若压缩过程中温度恒定,则下列说法中不正确的是( )
| A. | m+n<p | B. | 平衡向逆反应方向移动 | ||
| C. | C的体积分数增大 | D. | A的转化率降低 |
16.原子核外电子是分层排布的,在不同电子层上运动的电子的能量不同,下列电子层上运动的电子能量最高的是( )
| A. | K层 | B. | L层 | C. | M层 | D. | N层 |
 .
.