题目内容
6.将2.30g金属钠投入50mL水中,反应完全后加水稀释至100mL得到NaOH溶液,取出15.0mL NaOH溶液,缓慢通入224mL CO2,完全反应得到Na2CO3和NaHCO3的混合溶液.(气体体积为标准状况下).(1)100mL NaOH溶液的物质的量浓度1mol•L-1.
(2)混合溶液中c(CO32-):(HCO3-)=1:1.
分析 (1)金属钠投入水中发生反应2Na+2H2O=2NaOH+H2↑,由反应可以推出生成的NaOH的物质的量可以计算出 NaOH溶液的物质的量浓度;
(2)CO2通入NaOH溶液反应得到Na2CO3和NaHCO3,由钠元素守恒和碳原子守恒可以求得生成的Na2CO3和NaHCO3的物质的量,可以计算出混合溶液中c(CO32-)和(HCO3-)的比例.
解答 解:(1)n=$\frac{2.3g}{23g/mol}$=0.1mol
2Na+2H2O=2NaOH+H2↑
2 2
0.1mol n(NaOH)
n(NaOH)=0.1mol
C(NaOH)=$\frac{0.1mol}{0.1L}$=1mol/L;
(2)设Na2CO3的物质的量为xNaHCO3的物质的量为y,由元素守恒得:
$\left\{\begin{array}{l}{x+y=0.01}\\{2x+y=0.1×\frac{15}{100}}\end{array}\right.$ x=0.005mol y=0.005mol
所以c(CO32-):(HCO3-)=1:1
故答案为:(1)1;(2)1:1.
点评 本题主要考查有关化学方程式的计算,题目难度较大,解答本题的关键是元素守恒,然后利用数据间的关系计算出要求的量,试题充分考查了学生的分析、理解能力.

练习册系列答案
相关题目
16.一定量碳(由12C、13C组成)和足量氧气(由16O组成)反应所得CO2气体,对氢气的相对密度为22.495,则该碳中12C和13C的原子个数比为( )
| A. | 1:99 | B. | 1:100 | C. | 100:1 | D. | 99:1 |
14.某水溶液中可能含有Na+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、SO42-离子中的若干种.某同学取200mL该溶液分成两等份依次进行如下实验:①向第一份溶液中加过量的NaOH溶液后加热,充分反应后生成0.02mol气体,无沉淀产生,同时得到溶液甲.②向溶液甲中通入过量的CO2气,充分反应生成白色沉淀,沉淀经过滤、洗涤、灼烧至恒重得到1.02g固体.③向第二份溶液中加入足量的BaCl2溶液,充分反应生成白色沉淀,沉淀用盐酸充分洗涤、干燥,得到11.65g固体.据此,该同学得到的结论正确的是( )
| A. | 实验①中产生的气体为氨,并可得原溶液中c(NH4+)=0.1 mol•L-1 | |
| B. | 实验③中的沉淀里一定有BaSO4,可能有Mg(OH)2 | |
| C. | 若要确定原溶液中是否含有Cl-,无需另外再设计实验验证 | |
| D. | 原溶液中一定含有Na+,且c(Na+)≥0.2 mol•L-1 |
11.下列操作或装置能达到实验目的是( )
| A. | 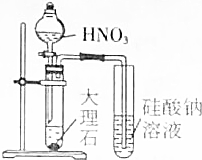 证明HNO3酸性比H2CO3强 | B. | 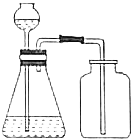 实验室用二氧化锰和盐酸制氯气 | ||
| C. | 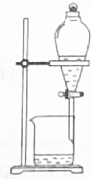 分离溴苯和苯 | D. | 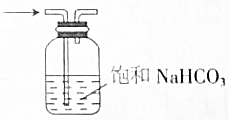 除去CO2中SO2 |
 某化学课外小组用图装置制取溴苯.
某化学课外小组用图装置制取溴苯. .
. $→_{△}^{氧化/催化剂}$
$→_{△}^{氧化/催化剂}$ $→_{△}^{H_{2}/Ni}$
$→_{△}^{H_{2}/Ni}$
 .
. .
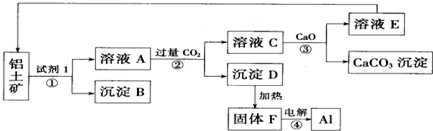
.
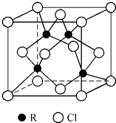 物质的组成、结构都是决定物质性质的重要因素.
物质的组成、结构都是决定物质性质的重要因素.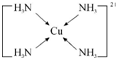 ,其中配体分子中心原子的杂化方式为sp3,与外界离子互为等电子体的一种分子的化学式为SiCl4或SiF4.
,其中配体分子中心原子的杂化方式为sp3,与外界离子互为等电子体的一种分子的化学式为SiCl4或SiF4.