题目内容
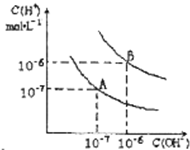 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:(1)则25℃时水的电离平衡曲线应为
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为
(3)25℃时,将pH=13的NaOH溶液l0mol逐滴滴入PH=1的CH3COOH溶液10ml中,反应后溶液的pH
(4)-50℃时,液氨存在如下电离:2NH3?NH4++NH2-,K=2×10-12,往液氨中加入NH4C1固体,K
考点:pH的简单计算,酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:(1)水的电离是吸热过程,降低温度抑制水电离,导致水中c(H+)、c(OH-)都减小;
(2)根据溶液的pH计算出溶液中氢离子、氢氧根离子浓度,再列式计算出氢氧化钠溶液和硫酸溶液的体积;
(3)将pH=13的NaOH溶液物质的量浓度是0.1mol/L,PH=1的CH3COOH溶液中醋酸的物质的量浓度大于0.1mol/L,最终得到醋酸钠和醋酸的混合溶液;
(4)弱电解质的电离平衡常数与温度有关,温度不变,电离平衡常数不变.
(2)根据溶液的pH计算出溶液中氢离子、氢氧根离子浓度,再列式计算出氢氧化钠溶液和硫酸溶液的体积;
(3)将pH=13的NaOH溶液物质的量浓度是0.1mol/L,PH=1的CH3COOH溶液中醋酸的物质的量浓度大于0.1mol/L,最终得到醋酸钠和醋酸的混合溶液;
(4)弱电解质的电离平衡常数与温度有关,温度不变,电离平衡常数不变.
解答:
解:(1)水的电离是吸热过程,升高温度,使水的电离程度增大,当温度升高时,促进水的电离,水的离子积增大,水中氢离子、氢氧根离子浓度都增大,水的pH减小,但溶液仍然呈中性,故答案为:A;
(2)25℃时所得混合溶液的pH=7,溶液呈中性即酸碱恰好中和,即n(OH-)=n(H+),则V(NaOH)?10-5 mol?L-1=V(H2SO4)?10-4 mol?L-1,得V(NaOH):V(H2SO4)=10:1;混合溶液中c(OH-)=
=0.1mol/L,c(H+)=
=10-11 mol/L,则溶液的pH=11,故答案为:10:1;11;
(3)将pH=13的NaOH溶液物质的量浓度是0.1mol/L,pH=1的CH3COOH溶液中醋酸的物质的量浓度大于0.1mol/L,25℃时,将pH=13的NaOH溶液l0mol逐滴滴入pH=1的CH3COOH溶液10ml中,酸剩余,则溶液呈酸性,溶液的pH<7,
故答案为:<;
(4)往液氨中加入氯化铵,氯化铵中含有铵根离子能抑制液氨电离,弱电解质的电离平衡常数与温度有关,温度不变,则液氨的电离平衡常数不变,故答案为:=.
(2)25℃时所得混合溶液的pH=7,溶液呈中性即酸碱恰好中和,即n(OH-)=n(H+),则V(NaOH)?10-5 mol?L-1=V(H2SO4)?10-4 mol?L-1,得V(NaOH):V(H2SO4)=10:1;混合溶液中c(OH-)=
| (0.3-0.1)mol/L×0.25L |
| 0.25L×2 |
| 10-6×10-6 |
| 0.1 |
(3)将pH=13的NaOH溶液物质的量浓度是0.1mol/L,pH=1的CH3COOH溶液中醋酸的物质的量浓度大于0.1mol/L,25℃时,将pH=13的NaOH溶液l0mol逐滴滴入pH=1的CH3COOH溶液10ml中,酸剩余,则溶液呈酸性,溶液的pH<7,
故答案为:<;
(4)往液氨中加入氯化铵,氯化铵中含有铵根离子能抑制液氨电离,弱电解质的电离平衡常数与温度有关,温度不变,则液氨的电离平衡常数不变,故答案为:=.
点评:本题考查水的电离和酸、碱混合的pH计算问题,难度较大,注意温度不同而使水的离子积常数不同是解本题的关键,注意无论温度多高,纯水中始终氢离子浓度等于氢氧根离子浓度,呈中性,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质的正确方法是 ( )(选填编号).
| A、蒸馏 |
| B、用氢氧化钠溶液洗涤 |
| C、用四氯化碳萃取 |
| D、用亚硫酸钠溶液洗涤 |
豪猪烯(hericenes),形状宛如伏地伸刺的动物,其键线式如图.下列有关豪猪烯的说法正确的是( )
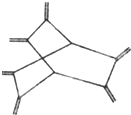

| A、豪猪烯与乙烯互为同系物 |
| B、豪猪烯分子中所有原子在同一平面 |
| C、豪猪烯的分子式为:C14H20 |
| D、豪猪烯能使酸性高锰酸钾溶液褪色 |
在盛放酒精的试剂瓶的标签上应印有的警示标志是( )
A、 |
B、 |
C、 |
D、 |

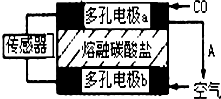 2014年初,雾霾天气多次肆虐我国中东部地区.加强汽车尾气排放监测和降低有毒气体的排放对于减少雾霾具有重要的意义.
2014年初,雾霾天气多次肆虐我国中东部地区.加强汽车尾气排放监测和降低有毒气体的排放对于减少雾霾具有重要的意义. [化学-选修3:物质结构与性质]
[化学-选修3:物质结构与性质]