题目内容
为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要.
(1)汽车内燃机工作时会引起N2和O2的反应:N2(g)+O2(g)?2NO(g),是导致汽车尾气中含有NO的原因之一.
①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图1所示,根据图象判断反应N2(g)+O2(g)?2NO(g)的△H 0(填“>”或“<”).

②在T3温度下,向2L密闭容器中充入10mol N2与5mol O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率v(N2)= .该温度下,若开始时向上述容器中充入N2与O2均为1mol,则达到平衡后N2的转化率为 .
(2)利用图2所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2.
①阳极的电极反应式为 .
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成.该反应中氧化剂与还原剂的物质的量之比为 .
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染.常温下,将a mol?L-1的醋酸与b mol?L-1 Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka= (用含a和b的代数式表示).
(1)汽车内燃机工作时会引起N2和O2的反应:N2(g)+O2(g)?2NO(g),是导致汽车尾气中含有NO的原因之一.
①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图1所示,根据图象判断反应N2(g)+O2(g)?2NO(g)的△H

②在T3温度下,向2L密闭容器中充入10mol N2与5mol O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率v(N2)=
(2)利用图2所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2.
①阳极的电极反应式为
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成.该反应中氧化剂与还原剂的物质的量之比为
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染.常温下,将a mol?L-1的醋酸与b mol?L-1 Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=
考点:化学平衡建立的过程,常见化学电源的种类及其工作原理,化学平衡的影响因素,弱电解质在水溶液中的电离平衡
专题:基本概念与基本理论
分析:(1)①根据“先拐先平数值大”原则判断的T1、T2大小,再根据平衡时氮气的体积分数判断温度对平衡的影响;
②利用三段式求出反应混合物各组分物质的量的变化量、平衡时反应混合物各组分物质的量,再求出平衡浓度,代入平衡常数表达式计算;再根据反应速率和转化率定义计算;
(2)①依据电极原理和反应过程中的离子变化写出电极反应;
②依据在碱性条件下,阴极排出的溶液为S2O42-,二氧化氮与其发生反应4S2O42-+2NO2+8OH-═8SO42-+N2+4H2O,依据方程式即可解答;
(3)溶液等体积混合溶质浓度减少一半,醋酸电离平衡常数与浓度无关,结合概念计算;
②利用三段式求出反应混合物各组分物质的量的变化量、平衡时反应混合物各组分物质的量,再求出平衡浓度,代入平衡常数表达式计算;再根据反应速率和转化率定义计算;
(2)①依据电极原理和反应过程中的离子变化写出电极反应;
②依据在碱性条件下,阴极排出的溶液为S2O42-,二氧化氮与其发生反应4S2O42-+2NO2+8OH-═8SO42-+N2+4H2O,依据方程式即可解答;
(3)溶液等体积混合溶质浓度减少一半,醋酸电离平衡常数与浓度无关,结合概念计算;
解答:
解:(1)①根据图象判断,T2曲线先到达平衡,反应速率大,温度较高,而温度升高,氮气的体积分数减小,说明升高温度平衡向正反应移动,升高温度向吸热方向进行,故正反应为吸热反应△H>0;
故答案为:>;
②令N2转化的物质的量为xmol,则
N2(g)+O2(g)?2NO(g),
起始(mol):10 5 0
反应(mol):1 1 2
平衡(mol):9 4 2
N2的反应速率=
=0.01 mol?L-1?s-1;
平衡常数
=
令N2转化的物质的量为xmol,则
N2(g)+O2(g)?2NO(g),
起始(mol):1 1 0
反应(mol):x x 2x
平衡(mol):1-x 1-x 2x
所以
=
,解得x=
,
N2的转化率为
×100%=14.3%;
故答案为:0.01 mol?L-1?s-1,14.3%;
(2)①依据图示可知,二氧化硫被氧化为硫酸根,所以二氧化硫所在的区为阳极区,阳极区发生反应SO2-2e-+2H2O═SO42-+4H+;
故答案为:SO2+2H2O-2e-=SO42-+4H+;
②阴极排出的溶液为S2O42-,二氧化氮与其发生反应,S2O42-中硫元素由+3价,变为硫酸根中硫元素为+4价,S2O42-被氧化是还原剂;二氧化氮中的氮元素化合价为+4价变为氮气0价,二氧化氮被还原为氧化剂,依据原子守恒和得失电子守恒可得,发生的离子方程式为4S2O42-+2NO2+8OH-═8SO42-+N2+4H2O,所以该反应中氧化剂与还原剂的物质的量之比为1:2,
故答案为:1:2;
(3)通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,溶液中溶质为醋酸钡和氢氧化钡,反应平衡时,2c(Ba2+)=c(CH3COO-)=bmol/L,溶液中c(H+)=c(OH-)=10-7mol/L,溶液呈中性,醋酸电离平衡常数依据电离方程式写出K=
=
=
×10-7L/mol;
用含a和b的代数式表示该混合溶液中醋酸的电离常数为
×10-7L/mol;
故答案为:
×10-7L/mol;
故答案为:>;
②令N2转化的物质的量为xmol,则
N2(g)+O2(g)?2NO(g),
起始(mol):10 5 0
反应(mol):1 1 2
平衡(mol):9 4 2
N2的反应速率=
| ||
| 50s |
平衡常数
(
| ||||
|
| 1 |
| 9 |
令N2转化的物质的量为xmol,则
N2(g)+O2(g)?2NO(g),
起始(mol):1 1 0
反应(mol):x x 2x
平衡(mol):1-x 1-x 2x
所以
(
| ||||
|
| 1 |
| 9 |
| 1 |
| 7 |
N2的转化率为
| ||
| 1mol |
故答案为:0.01 mol?L-1?s-1,14.3%;
(2)①依据图示可知,二氧化硫被氧化为硫酸根,所以二氧化硫所在的区为阳极区,阳极区发生反应SO2-2e-+2H2O═SO42-+4H+;
故答案为:SO2+2H2O-2e-=SO42-+4H+;
②阴极排出的溶液为S2O42-,二氧化氮与其发生反应,S2O42-中硫元素由+3价,变为硫酸根中硫元素为+4价,S2O42-被氧化是还原剂;二氧化氮中的氮元素化合价为+4价变为氮气0价,二氧化氮被还原为氧化剂,依据原子守恒和得失电子守恒可得,发生的离子方程式为4S2O42-+2NO2+8OH-═8SO42-+N2+4H2O,所以该反应中氧化剂与还原剂的物质的量之比为1:2,
故答案为:1:2;
(3)通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,溶液中溶质为醋酸钡和氢氧化钡,反应平衡时,2c(Ba2+)=c(CH3COO-)=bmol/L,溶液中c(H+)=c(OH-)=10-7mol/L,溶液呈中性,醋酸电离平衡常数依据电离方程式写出K=
| c(CH3COO-c(H+)) |
| c(CH3COOH) |
| b×10-7 | ||
|
| 2b |
| a-2b |
用含a和b的代数式表示该混合溶液中醋酸的电离常数为
| 2b |
| a-2b |
故答案为:
| 2b |
| a-2b |
点评:本题考查热化学方程式,化学平衡常数、化学平衡影响因素分析,原电池原理的分析应用,主要是弱电解质电离平衡常数的计算,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2014年5月7日南京某建设公司丢失用于材料探伤的放射源Ir-192(铱-192)一枚,经相关部门的努力追查,丢失的放射源于5月10日被回收,Ir-192的放射性会对人体产生很大的伤害.已知Ir元素位于周期表中第6周期第Ⅷ族,原子序数为77,192为该核素的质量数,下列关于Ir-192的说法正确的是( )
| A、Ir-192核外含有115个电子 |
| B、Ir为非金属元素 |
| C、Ir-192中子数与质子数的差为38 |
| D、Ir元素与碘元素位于同一周期 |
下列关于有机物说法正确的是( )
| A、制乙酸乙酯时,把乙醇和乙酸依次加入浓硫酸中 |
| B、纤维素和淀粉都是多糖,二者互为同分异构体 |
| C、煤的干馏是物理变化,煤的气化和液化是化学变化 |
| D、三大合成材料是塑料、合成纤维和合成橡胶 |
研究出元素周期律并列出第一张元素周期表的伟大科学家是( )
| A、门捷列夫 | B、哈伯 |
| C、舍勒 | D、侯德榜 |
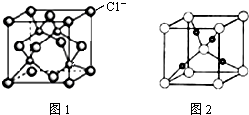 我国的铜矿储量居世界第三位,主要集中在江西、云南、甘肃、湖北、安徽、西藏等.铜及其化合物在现代社会中有着极其广泛的应用.
我国的铜矿储量居世界第三位,主要集中在江西、云南、甘肃、湖北、安徽、西藏等.铜及其化合物在现代社会中有着极其广泛的应用. 四种元素A、B、C、D位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为50;A元素原子的核外只有一个电子;B元素原子的L层p轨道中有2个电子;C元素原子与B元素原子的价层电子数相同;D原子的最外层电子数为1,其d轨道中的电子数与K层电子数之比为5:1.
四种元素A、B、C、D位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为50;A元素原子的核外只有一个电子;B元素原子的L层p轨道中有2个电子;C元素原子与B元素原子的价层电子数相同;D原子的最外层电子数为1,其d轨道中的电子数与K层电子数之比为5:1.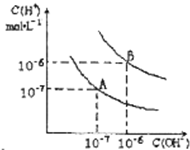 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: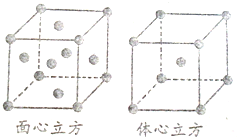 (1)氯化铝常温下为固体,熔点190℃(253kPa),易升华.实验室氯化铝蒸气的密度为11.92g?L-1(已折算成标准状况),据此判断氯化铝晶体为
(1)氯化铝常温下为固体,熔点190℃(253kPa),易升华.实验室氯化铝蒸气的密度为11.92g?L-1(已折算成标准状况),据此判断氯化铝晶体为