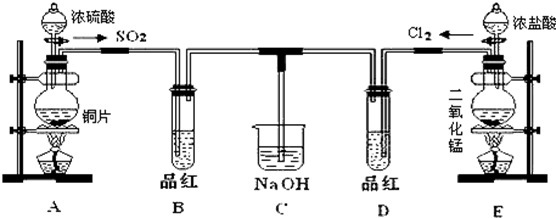
题目内容
9.《中华人民共和国安全生产法》指出安全生产工作应当以人为本,坚持安全发展、预防为主、综合治理的方针.下列做法不正确的是( )| A. | 面粉生产车间应严禁烟火 | |
| B. | 含Cl2的尾气用碱溶液处理后再排放 | |
| C. |  天然气运输时应悬挂图所示的标志 | |
| D. | 金属钠失火时应立即用大量冷水扑灭 |
分析 A.面粉厂有可燃性的粉尘,遇到焰火容易发生爆炸;
B.氯气有毒,能够污染空气;
C.依据天然气易燃烧的性质;
D.钠能与水剧烈反应生成氢气.
解答 解:A.面粉厂有可燃性的粉尘,遇到焰火容易发生爆炸,所以生产车间应严禁烟火,故A正确;
B.氯气有毒,能够污染空气,氯气能够与氢氧化钠容易反应,被氢氧化钠吸收而减少环境污染,故B正确;
C.天然气易燃烧,运输时应悬挂图所示的标志: ,故C正确;
,故C正确;
D.钠能与水剧烈反应生成氢气,氢气为易燃气体,所以金属钠失火时不应立即用大量冷水扑灭,应该用沙土灭火,故D错误;
故选:D.
点评 本题考查了化学实验安全,熟悉相关物质的性质是解题关键,题目难度不大,注意积累.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.如表实验中,对应的现象以及结论都正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 将气体X通入品红溶液和酸性高锰酸钾溶液 | 两溶液均褪色 | X可能是乙烯 |
| B | 向淀粉溶液中加入稀H2SO4,水浴加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热 | 无砖红色沉淀生成 | 表明淀粉没有水解生成葡萄糖 |
| C | 向含有Cl-和SO42-溶液中,加入过量的硝酸化的Ba(NO3)2溶液,过滤,向滤液中再滴加AgNO3溶液 | 有白色沉淀生成 | 证明溶液中有Cl- |
| D | 向盛有5mL0.005mol•L-1 FeCl3溶液的试管中加入5mL0.01mol•L 1KSCN溶液后,再加入4滴0.1mol•L -1KSCN溶液 | 溶液红色加深 | Fe3++3SCN-?Fe(SCN)3可逆反应 |
| A. | A | B. | B | C. | C | D. | D |
3.下列物质中含有离子键的是( )
| A. | CO2 | B. | NaCl | C. | HCl | D. | CH4 |
6.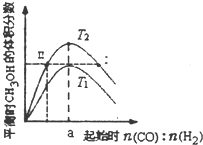 在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2(g)?CH3OH(g)△H<0达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化关系如图所示.则下列结论正确的是( )
在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2(g)?CH3OH(g)△H<0达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化关系如图所示.则下列结论正确的是( )
 在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2(g)?CH3OH(g)△H<0达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化关系如图所示.则下列结论正确的是( )
在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2(g)?CH3OH(g)△H<0达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化关系如图所示.则下列结论正确的是( )| A. | 由图象可推知,反应温度T2>T1 | |
| B. | 同一温度,增大压强,平衡右移,平衡常数K增大 | |
| C. | 同一温度,当a=0.5时,CO转化率最高 | |
| D. | 对于状态I和II,若再向体系中充入He,重新达到平衡后,二者的平衡体系中CH3OH的浓度相等 |
14.短周期主族元素X、Y、Z、W的原子序数依次增大.X、W在同一主族,Z+与Y3-具有相同的电子层结构,X原子的最外层电子数是其内层电子数的2倍.下列说法正确的是( )
| A. | 粒子半径的大小顺序:r(W)>r(X)>r(Z+)>r(Y3-) | |
| B. | X的最高价氧化物对应水化物的酸性比Y的强 | |
| C. | W的气态简单氢化物的热稳定性比X的强 | |
| D. | 工业上可用X的单质与W的氧化物反应制备W的单质 |
18.有关化学资源的合成、利用与开发的叙述合理的是( )
| A. | 大量使用化肥和农药,能不断提高农作物产量 | |
| B. | 开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理 | |
| C. | 通过有机合成,可以制造出比钢铁更强韧的新型材料 | |
| D. | 安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率 |