题目内容
10.下列事实中,不能用勒夏特列原理解释的是( )| A. | 打开汽水瓶.有气泡从溶液中冒出 | |
| B. | H2、I2、HI混合气体加压后颜色变深 | |
| C. | 实验室中常用排饱和食盐水的方法收集 | |
| D. | 合成氨工业采用高压条件 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动.使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A、气体的溶解度随温度的升高而减小,随压强的增大而增大,由气体的溶解度随压强的增大而增大,因此常温时打开汽水瓶时,瓶内的压强减小,因此瓶内的二氧化碳会从瓶中溢出,可以用勒夏特列原理解释,故A不选;
B、由H2、I2(g)、HI气体组成的平衡,反应前后气体体积不变,减压后平衡不动,体积增大颜色变浅,不能用勒夏特列原理解释,故B选;
C、实验室用排饱和食盐水法收集氯气,利用饱和食盐水中氯离子浓度使平衡逆向进行,Cl2+H2O?H++Cl-+HClO,可以用勒夏特列原理解释,故C不选;
D、合成氨反应是气体体积减小的反应,合成氨工厂学采用增大压强以提高原料的利用率,可以用勒夏特列原理解释,故D不选;
故选B.
点评 本题考查了化学平衡移动原理的分析判断,影响因素的分析,平衡移动原理的理解是解题关键,题目难度中等.

练习册系列答案
相关题目
20.下列各组物质反应时,改变反应条件或者反应物的物质的量之比,生成的产物不变的是( )
| A. | Na与氧气 | B. | 澄清石灰水与二氧化碳 | ||
| C. | 氯化铝溶液与氢氧化钠溶液 | D. | Al与稀盐酸 |
1.下列化学用语表示正确的是( )
| A. | 过氧化钠的化学式:Na2O | |
| B. | 氯化钙化学式:CaCl | |
| C. | 铝的原子结构示意图: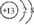 | |
| D. | 硫酸钠的电离方程式:Na2SO4═2Na++SO42- |
5.下列说法正确的是( )
| A. | 已知X在一定条件下转化为Y,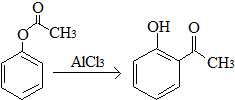 ,X与Y互为同分异构体,可用FeCl3溶液鉴别 ,X与Y互为同分异构体,可用FeCl3溶液鉴别 | |
| B. | 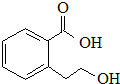 能发生的反应类型有:加成反应、取代反应、消去反应、水解反应 能发生的反应类型有:加成反应、取代反应、消去反应、水解反应 | |
| C. | 淀粉、蛋白质最终的水解产物都只有一种 | |
| D. | 香柠檬粉具有抗氧化功能,结构为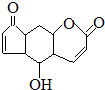 它与溴水发生反应,1mol最多消耗3molBr2,它与NaOH溶液反应,1mol最多消耗2molNaOH 它与溴水发生反应,1mol最多消耗3molBr2,它与NaOH溶液反应,1mol最多消耗2molNaOH |
15.某溶液中,只含有下表中所示的四种离子(忽略水的电离),则X离子及其物质的量浓度b可能为( )
| 离子 | Mg2+ | Al3+ | Cl- | X |
| 物质的量浓度 | a | 2a | 2a | b |
| A. | Na+、6a | B. | SO42-、3a | C. | OH-、6a | D. | CO32-、4a |
2.用食用白醋(醋酸浓度约1mol/L)进行下列实验,能证明醋酸为弱电解质的是( )
| A. | 白醋中滴入石蕊试液呈红色 | B. | 白醋加入豆浆中有沉淀产生 | ||
| C. | pH 试纸显示白醋的 pH 为 2~3 | D. | 蛋壳浸泡在白醋中有气体放出 |
19.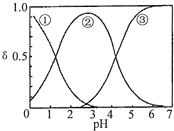 H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示,下列说法正确的是( )
H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示,下列说法正确的是( )
 H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示,下列说法正确的是( )
H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示,下列说法正确的是( )| A. | 曲线①代表的粒子是HC2O4- | |
| B. | 0.1 mol•L-1 NaHC2O4溶液中:c(Na+)=c(C2O42-)+c(H2C2O4)+c(HC2O4-) | |
| C. | pH=5时,溶液中主要含碳微粒浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-) | |
| D. | 在一定温度下,往CaC2O4饱和溶液中加入少量CaCl2固体,c(Ca2+)不变,c(C2O42-)将减小.(CaC2O4难溶于水) |
20.设NA为阿伏加德罗常数的值,则下列说法不正确的是( )
| A. | 14g乙烯和环丙烷混合物中含有的碳原子数目为NA | |
| B. | 1.6g甲烷完全燃烧生成二氧化碳和水,转移的电子数为0.8NA | |
| C. | 0.1mol乙炔分子中含有的共用电子对数目为0.5NA | |
| D. | 在标准状态下,2.24L己烷含有的氢原子数目为1.4NA |