题目内容
7.下列解释实验事实的方程式正确的是( )| A. | 氨水中滴入酚酞溶液,溶液变红:NH3•H2O=NH4++OH- | |
| B. | 90℃时,测得纯水中c(H+)•c(OH-)=3.8×10-13:H2O(l)?H+(aq)+OH-(aq)△H<0 | |
| C. | 向苯酚钠溶液中通入CO2,溶液变浑浊:2C6H5ONa+CO2+H2O→2C6H5OH+Na2CO3 | |
| D. | FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2 +2H2O=2Fe2++SO42-+4H+ |
分析 A、一水合氨是弱电解质;
B、弱电解质的电离是吸热过程;
C、酸性强弱是H2CO3>C6H5OH>HCO3-;
D、向FeCl3溶液中通入一定量的SO2气体,溶液由黄色变为浅绿色,发生2Fe3++SO2+2H2O═2Fe2++SO42-+4H+;
解答 解:A、一水合氨是弱电解质,所以电离用可逆符号,电离方程式为:NH3•H2O=NH4++OH-,故A错误;
B、弱电解质的电离是吸热过程,所以△H>0,故B错误;
C、酸性强弱是H2CO3>C6H5OH>HCO3-,所以反应方程式为C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,故C错误
D、向FeCl3溶液中通入一定量的SO2气体,溶液由黄色变为浅绿色,发生2Fe3++SO2+2H2O═2Fe2++SO42-+4H+,故D正确;
故选D.
点评 本题考查弱电解质的电离和离子反应方程式的书写,学生只要掌握离子反应发生的条件和转化的规律就可以迅速解题,比较容易.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
17.下列有关化学键的叙述,正确的是( )
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 单质分子中均不存在化学键 | |
| C. | 化学键的常见类型为离子键、共价键和氢键 | |
| D. | 离子化合物中一定含有离子键 |
18.25℃时,1mol/L醋酸加水稀释至0.01mol/L,下列变化正确的是( )
| A. | 溶液中c(OH-)减小 | B. | pH的变化值小于2 | ||
| C. | 溶液中H+的数目增大 | D. | Kw的值减小 |
15. NO能引起光化学烟雾,破坏臭氧层.处理NO有多种方法,根据题意回答下列问题:
NO能引起光化学烟雾,破坏臭氧层.处理NO有多种方法,根据题意回答下列问题:
Ⅰ.利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO(g)+2CO(g) $\stackrel{催化剂}{?}$ 2CO2(g)+N2(g)△H=-748kJ/mol
为了测定某催化剂作用下的反应速率,在一定温度下,向某恒容密闭容器中充入等物质的量的NO和CO发生上述反应.用气体传感器测得不同时间NO浓度如表:
(1)前2s内的平均反应速率υ(N2)=2.08×10-4mol/(L•s)(保留3位有效数字,下同);计算此温度下该反应的K=3.65×106.
(2)达到平衡时,下列措施能提高NO转化率的是BD.(填字母序号)
A.选用更有效的催化剂B.降低反应体系的温度
C.充入氩气使容器内压强增大D.充入CO使容器内压强增大
(3)已知N2(g)+O2(g)=2NO(g)△H=+180kJ/mol;则CO的燃烧热为284kJ/mol.
Ⅱ.臭氧也可用于处理NO.
(4)O3氧化NO结合水洗可产生HNO3和O2,每生成1mol的HNO3转移3mol电子.
(5)O3可由电解稀硫酸制得,原理如图.图中阴极为B(填“A”或“B”),阳极(惰性电极)的电极反应式为3H2O-6e-=O3+6H+.
 NO能引起光化学烟雾,破坏臭氧层.处理NO有多种方法,根据题意回答下列问题:
NO能引起光化学烟雾,破坏臭氧层.处理NO有多种方法,根据题意回答下列问题:Ⅰ.利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO(g)+2CO(g) $\stackrel{催化剂}{?}$ 2CO2(g)+N2(g)△H=-748kJ/mol
为了测定某催化剂作用下的反应速率,在一定温度下,向某恒容密闭容器中充入等物质的量的NO和CO发生上述反应.用气体传感器测得不同时间NO浓度如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | … |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.00×10-4 | 1.70×10-4 | 1.00×10-4 | 1.00×10-4 | … |
(2)达到平衡时,下列措施能提高NO转化率的是BD.(填字母序号)
A.选用更有效的催化剂B.降低反应体系的温度
C.充入氩气使容器内压强增大D.充入CO使容器内压强增大
(3)已知N2(g)+O2(g)=2NO(g)△H=+180kJ/mol;则CO的燃烧热为284kJ/mol.
Ⅱ.臭氧也可用于处理NO.
(4)O3氧化NO结合水洗可产生HNO3和O2,每生成1mol的HNO3转移3mol电子.
(5)O3可由电解稀硫酸制得,原理如图.图中阴极为B(填“A”或“B”),阳极(惰性电极)的电极反应式为3H2O-6e-=O3+6H+.
12.下列有关14C60的叙述正确的是( )
| A. | 与12C60化学性质相同 | B. | 与12C60互为同素异形体 | ||
| C. | 属于原子晶体 | D. | 与12C60互为同位素 |
19.根据元素周期律,由下列事实进行归纳推测,合理的是( )
| 事实 | 推测 | |
| A | Mg与水反应缓慢,Ca与水反应较快 | Be与水反应会更快 |
| B | HCl在1500℃时分解,HI在230℃时分解 | HBr的分解温度介于二者之间 |
| C | SiH4,PH3在空气中能自燃 | H2S在空气中也能自燃 |
| D | 标况下HCl,HBr均为气体 | HF也为气体 |
| A. | A | B. | B | C. | C | D. | D |
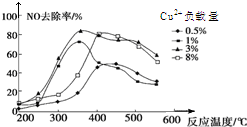 雾霾严重影响人们的生活,汽车尾气的排放是造成雾霾天气的重要原因之一.已知汽车尾气排放时容易发生以下反应:
雾霾严重影响人们的生活,汽车尾气的排放是造成雾霾天气的重要原因之一.已知汽车尾气排放时容易发生以下反应: