题目内容
A、B、C、D、E是中学化学五种常见元素,有关信息如表.
请回答下列问题:
(1)A的氢化物的水溶液能使酚酞溶液变红,原因是 (用电离方程式表示),实验室制取该氢化物的化学方程式是 .
A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的污染现象是 (填序号).①酸雨 ②温室效应 ③臭氧层破坏
(2)C的最高价氧化物的水化物电子式是 ,其中所含有的化学键是 ,该物质与D单质反应可用于生产漂白液,化学方程式是 .
(3)E在元素周期表中的位置是 .0.1mol/L E的硫酸盐溶液与0.1mol/L KOH溶液等体积混合,反应的离子方程式是 .由元素A、E组成某化合物,具有良好电绝缘性,该物质与水缓慢反应的化学方程式是 .
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 原子最外层电子数比次外层电子数少1个 |
| E | 单质既可与盐酸反应,又可与NaOH溶液反应 |
(1)A的氢化物的水溶液能使酚酞溶液变红,原因是
A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的污染现象是
(2)C的最高价氧化物的水化物电子式是
(3)E在元素周期表中的位置是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E五种短周期元素,原子序数依次增大,A元素最高价氧化物对应的水化物与其氢化物反应生成离子化合物,则A为N元素;B是地壳中含量最多的元素,则B为O元素;C的单质须保存在煤油中,则C为Na;D原子最外层电子数比次外层电子数少1个,最外层电子数=8-1=7,则E为Cl,E的单质既可与盐酸反应,又可与NaOH溶液反应,则D为Al;由原子序数可知E处于第三周期,据此解答.
解答:
解:A、B、C、D、E五种短周期元素,原子序数依次增大,A元素最高价氧化物对应的水化物与其氢化物反应生成离子化合物,则A为N元素;B是地壳中含量最多的元素,则B为O元素;C的单质须保存在煤油中,则C为Na;D原子最外层电子数比次外层电子数少1个,最外层电子数=8-1=7,则E为Cl,E的单质既可与盐酸反应,又可与NaOH溶液反应,则D为Al;由原子序数可知E处于第三周期,
(1)氨水中一水合氨电离:NH3?H2O?NH4++OH-,溶液呈碱性,能使酚酞试液变红;
实验室制取氨气的化学方程式是:2NH4Cl+Ca(OH)2
CaCl2+2NH3+2H2O,N与O可组成质量比为7:16的三原子分子,N原子与O原子数目之比=
:
=1:2,故该分子为NO2,NO2能导致酸雨、光化学污染等;
故答案为:NH3?H2O?NH4++OH-;2NH4Cl+Ca(OH)2
CaCl2+2NH3+2H2O;①;
(2)氢氧化钠中既含有离子键,又含有共价键;氢氧化钠与氯气反应生成氯化钠、次氯酸钠与水;
故答案为: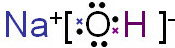 离子键 共价键 Cl2+2NaOH=NaCl+NaClO+H2O;
离子键 共价键 Cl2+2NaOH=NaCl+NaClO+H2O;
(3)E为Al元素,在元素周期表中的位置是第3周期ⅢA族;0.1mol/L E的硫酸盐溶液与0.1mol/L KOH溶液等体积混合,氢氧化钠不足,生成氢氧化铝沉淀;由元素N、Al组成某化合物,具有良好电绝缘性,该化合物为AlN,在水中发生水解反应生成氢氧化铝与氨气,化学方程式是:AlN+3H2O═Al(OH)3↓+NH3↑,
故答案为:第3周期ⅢA族、Al3++3OH-=Al(OH)3↓、AlN+3H2O=Al(OH)3↓+NH3↑.
(1)氨水中一水合氨电离:NH3?H2O?NH4++OH-,溶液呈碱性,能使酚酞试液变红;
实验室制取氨气的化学方程式是:2NH4Cl+Ca(OH)2
| ||
| 7 |
| 14 |
| 16 |
| 16 |
故答案为:NH3?H2O?NH4++OH-;2NH4Cl+Ca(OH)2
| ||
(2)氢氧化钠中既含有离子键,又含有共价键;氢氧化钠与氯气反应生成氯化钠、次氯酸钠与水;
故答案为:
 离子键 共价键 Cl2+2NaOH=NaCl+NaClO+H2O;
离子键 共价键 Cl2+2NaOH=NaCl+NaClO+H2O;(3)E为Al元素,在元素周期表中的位置是第3周期ⅢA族;0.1mol/L E的硫酸盐溶液与0.1mol/L KOH溶液等体积混合,氢氧化钠不足,生成氢氧化铝沉淀;由元素N、Al组成某化合物,具有良好电绝缘性,该化合物为AlN,在水中发生水解反应生成氢氧化铝与氨气,化学方程式是:AlN+3H2O═Al(OH)3↓+NH3↑,
故答案为:第3周期ⅢA族、Al3++3OH-=Al(OH)3↓、AlN+3H2O=Al(OH)3↓+NH3↑.
点评:本题考查结构性质位置关系应用,难度不大,明确元素是解题关键,侧重对化学用语的考查,需要学生熟练掌握基础知识.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
| A、常温常压下3.2 g O2中含有的氧原子数目为0.2 NA |
| B、101 kPa 0℃时,22.4 L氢气中含有NA个氢原子 |
| C、标准状况下,2.24 L 四氯化碳含有的碳原子数目为0.1NA |
| D、标准状况下,22.4LCl2和HCl的混合气体所含分子总数为2NA |
化学实验中常将某些溶液或试剂进行酸化或碱化.下列处理中正确的是( )
| A、检验C2H5Br中的Br元素时,将C2H5Br和NaOH溶液混合加热后,加硫酸酸化 |
| B、为提高KMnO4溶液的氧化能力,用浓盐酸将KMnO4溶液酸化 |
| C、检验蔗糖在稀硫酸中水解产生的葡萄糖,应先用NaOH溶液碱化后才能进一步检验 |
| D、检验溶液中是否含有SO42-时,先加氯化钡溶液后,再加稀盐酸酸化 |
 金属(M)的腐蚀是因为发生反应:M-ne-→Mn+.金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁的腐蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.
金属(M)的腐蚀是因为发生反应:M-ne-→Mn+.金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁的腐蚀最为严重,寻求防止钢铁腐蚀的方法意义重大. 研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义.