题目内容
2.下列反应的离子方程式书写正确的是( )| A. | 用FeCl3溶液腐蚀含铜印刷电路板:Cu+Fe3+═Cu2++Fe2+ | |
| B. | 澄清石灰水与过量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 将氯气溶氢氧化钠溶液:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 将磁性氧化铁溶于足量稀硝酸:Fe3O4+8H+═2Fe3++Fe2++4H2O |
分析 A.离子方程式两边正电荷不相等,违反了电荷守恒;
B.小苏打为碳酸氢钠,碳酸氢钠过量,离子方程式按照氢氧化钙的化学式组成书写;
C.氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
D.稀硝酸具有强氧化性,能够将亚铁离子氧化成铁离子.
解答 解:A.用FeCl3溶液腐蚀含铜印刷电路板,正确的离子方程式为:Cu+2Fe3+═Cu2++Fe2+,故A错误;
B.澄清石灰水与过量小苏打溶液混合,反应生成碳酸钠、碳酸钙沉淀和水,正确的离子方程式为:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32-,故B错误;
C.将氯气溶氢氧化钠溶液的离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O,故C正确;
D.将磁性氧化铁溶于足量稀硝酸,二者发生氧化还原反应,正确的离子方程式为:3Fe3O4+NO3-+28H+═9Fe3++14H2O+NO↑,故D错误;
故选C.
点评 本题考查了离子方程式的判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列离子方程式书写正确的是( )
| A. | 少量SO2通入NaClO溶液中:SO2+3ClO-+H2O═SO42-+Cl-+2HClO | |
| B. | 等物质的量的MgCl2、Ba(OH)2 和HCl溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| C. | 用硫氰化钾溶液可以检验溶液中的Fe3+:Fe3++3SCN-═Fe(SCN)3↓ | |
| D. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制 Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ |
17.将20g Ba(OH)2•8H2O晶体与10g NH4Cl晶体一起放入小烧杯中,并将烧杯放在滴有几滴水的玻璃片上,用玻璃棒快速搅拌晶体.则下列说法正确的是( )
| A. | 实验中玻璃棒的作用是加速固体溶解 | |
| B. | 玻璃片上结冰而与小烧杯粘在一起,说明该反应是放热反应 | |
| C. | 反应中断开化学键吸收的总能量低于形成化学键放出的总能量 | |
| D. | 该反应中,反应物的总能量小于生成物的总能量 |
14.某试剂能把乙醇、乙酸、葡萄糖溶液区别开,这种试剂是( )
| A. | 新制Cu(OH)2悬浊液 | B. | 溴水 | ||
| C. | 钠 | D. | 酸性高锰酸钾溶液 |
12.某物质具有较低的熔点和沸点,且又难溶于水,这种物质可能是( )
| A. | 原子晶体 | B. | 非极性分子型物质 | ||
| C. | 极性分子型物质 | D. | 离子晶体 |
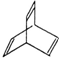 有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式
有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式
 、
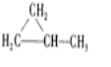
、
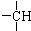 及一个-Cl,它的可能结构只有四种.请写出这四种可能的结构简式
及一个-Cl,它的可能结构只有四种.请写出这四种可能的结构简式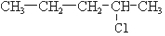 ②
②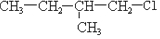
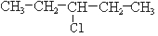 ④
④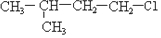 .
. 根据组成原电池的条件,设计一个原电池,画出示意图并标出原电池的正、负极和电子的流向(画在下面方框中),写出电极反应式.
根据组成原电池的条件,设计一个原电池,画出示意图并标出原电池的正、负极和电子的流向(画在下面方框中),写出电极反应式.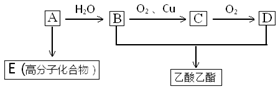 已知:
已知: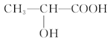 乳酸兼有乙酸和乙醇所具有的化学性质现以A为原料合成乙酸乙酯及高分子化合物E,其合成路线如图所示:
乳酸兼有乙酸和乙醇所具有的化学性质现以A为原料合成乙酸乙酯及高分子化合物E,其合成路线如图所示: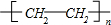 .
. .
.