题目内容
5.实验室制配0.2mol/L的NaOH溶液250mL,有以下仪器:①烧杯 ②250mL容量瓶 ③500mL容量瓶 ④玻璃棒 ⑤托盘天平(带砝码)⑥滴定管(1)配制时,必须使用的仪器有①②④⑤(填代号),还缺少的仪器是胶头滴管.
(2)实验两次用到玻璃棒,其作用分别是:搅拌、加速溶解、引流.
(3)配制时,一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却.其正确的操作顺序为②①③⑧⑤⑥⑤⑦④.
(4)下列操作结果,使溶液物质的量浓度偏高的是BEF
A.没有将洗涤液转移到容量瓶中
B.称量时砝码生锈
C.转移过程中有少量的溶液溅出
D.摇匀后立即观察,发现溶液未达刻度线,再用滴管加几滴蒸馏水至刻度线
E.溶解后未冷却就将溶液转移进容量瓶
F.定容时俯视容量瓶刻度线
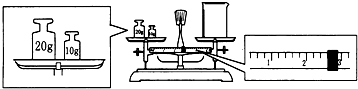
(5)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图.由如图中可以看出,该同学在操作时的一个错误是砝码与烧杯放反了位置,烧杯的实际质量为27.4g.
分析 (1)根据配制一定物质的量浓度的溶液的步骤是:计算、称量、溶解、移液、洗涤、定容、摇匀来选择使用的仪器;
(2)根据使用玻璃棒的操作来分析其用途;
(3)据配制溶液的实验操作过程进行实验步骤排序;
(4)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=$\frac{n}{V}$分析判断;
(5)天平称量物体时遵循左物右码的原则,天平平衡原理:左盘物体质量=右盘砝码质量+游码质量.
解答 解:(1)根据配制一定物质的量浓度的溶液的步骤是:计算、称量、溶解、移液、洗涤、定容、摇匀可知需要的仪器有:托盘天平、药匙、烧杯、玻璃棒、250mL容量瓶和胶头滴管,故必须使用的仪器有:①②④⑤,还缺少胶头滴管;
故答案为:①②④⑤;胶头滴管;
(2)在配制过程中,溶解氢氧化钠固体时玻璃棒的用途是:搅拌,加速溶解;在移液时玻璃棒的用途是引流,
故答案为:搅拌、加速溶解;引流;
(3)操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,所以操作顺序为②①③⑧⑤⑥⑤⑦④,
故答案为:②①③⑧⑤⑥⑤⑦④;
(4)A.没有将洗涤液转移到容量瓶中,会导致溶质的损失,则浓度偏低,故A错误;
B.砝码生锈后质量增大,故所称量出的固体的质量偏大,所配溶液的浓度偏高,故B正确;
C.转移过程中有少量的溶液溅出,会导致溶质的损失,则浓度偏低,故C错误;
D.摇匀后溶液未达刻度线是正常的,再用滴管加几滴蒸馏水至刻度线会导致浓度偏低,故D错误;
E.溶解后未冷却就将溶液转移进容量瓶,则冷却后溶液体积偏小,浓度偏高,故E正确;
F.定容时俯视容量瓶刻度线,则溶液的体积偏小,浓度偏高,故F正确,
故选BEF;
(5)天平称量物体时遵循左物右码的原则,在该实验图中可以看出,该同学在操作时的一个错误是砝码与烧杯放反了位置,根据天平平衡原理:左盘物体质量=右盘砝码质量+游码质量,若果放反了,则左盘砝码质量=右盘物体质量+游码质量,所以右盘物体质量=左盘砝码质量-游码质量=30g-2.6g=27.4g,
故答案为:砝码与烧杯放反了位置;27.4.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案| A. | 苯(硝基苯):加少量蒸馏水振荡,待分层后分液 | |
| B. | 乙醇(水):加新制的生石灰,蒸馏 | |
| C. | NH3(水蒸气):通过盛有碱石灰的干燥管 | |
| D. | 乙烷(乙烯):通入氢气发生加成反应 |
| A. | 1.2mol/L | B. | 0.3mol/L | C. | 1.4mol/L | D. | 无法计算 |
| A. | 20 | B. | 50 | C. | 0.05 | D. | 无法确定 |
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol 据此回答以下问题:
(1)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是②③(填序号).
①反应压强为20Mpa~50Mpa
②500℃的高温
③铁触媒作催化剂
④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中.
(2)一定条件下NH3的平衡体积分数随n(N2)变化如图所示(T-温度).

则T2T2<T1T1(填>、=、<),判断的依据是:合成氨反应是放热反应,温度升高,平衡向逆反应方向移动,NH3的体积分数下降,所以T2<T1.
(3)合成氨气所需的氢气可以由水煤气分离得到.涉及反应信息如下:
反应一:C(s)+H2O(g)?H2(g)+CO(g) 平衡常数K1
反应二:CO(g)+H2O(g)?H2(g)+CO2(g) 平衡常数K2
①K1的表达式:K1=$\frac{c(H2)c(CO)}{c(H2O)}$.
②将一定量的H2O(g)和CO(g)分别通入到体积为1L的密闭容器中,在不同条件下进行反应,得到以下三组数据:
| 实验组别 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 2 | 900 | 0.5 | 1 | 0.2 | 0.8 | 3 |
| 3 | T | a | b | c | d | t |
(Ⅱ)在实验3,当a=0.5、b=1时,要使c、d数据与实验2相同,且t<3,可以采取的措施为D(填序号)
A.其它条件不变温度T<900℃
B.其它条件不变温度T>900℃
C.充入一定量氖气
D.使用高效催化剂
(Ⅲ)对于反应二,当升高温度时K2减小(填“增大”、“减小”或“不变”).
①原子数目
②分子数目
③元素种类
④物质的总质量
⑤物质的量
⑥原子的种类
⑦物质的体积.
| A. | ①④⑥⑦ | B. | ①②③⑤ | C. | ①③④⑥ | D. | ①③④⑤⑥⑦ |
| A. | 都不稳定,密闭放置可产生沉淀 | |
| B. | 两者都有“丁达尔效应” | |
| C. | 加入氢氧化钠溶液二者都能沉淀,Fe(OH)3胶体发生聚沉,MgCl2发生化学反应生成沉淀 | |
| D. | 两者都能透过半透膜 |
 .
.