题目内容
我国钾长石(KAlSi3O8)的资源比较丰富.一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s)?KCl(l)+NaAlSi3O8(s).
(1)上述反应涉及的第三周期元素中,离子半径最小的是 (用元素符号表示).Cl原子与Si原子可以形成的五核分子,其化学键键长和键角都相等,则该物质为 分子(填“极性”或“非极性”),该分子的电子式为 .
(2)不能用于比较Na与Al金属性相对强弱的事实是 .
A.最高价氧化物对应水化物的碱性 B.Na和Al的熔点高低
C.单质与H2O反应的难易程度 D.比较同浓度NaCl和AlCl3的pH值
(3)上述元素的最高价氧化物对应水化物中,有一种既能与强酸又能与强碱反应,其原因在于: (用电离方程式表示).
(4)钾长石和烧碱在熔融状态下反应可得到两种正盐,向所得的正盐中加入过量稀盐酸,发生反应的离子方程式分别是: 、 .
(5)制取粗硅的过程中,SiO是反应中间产物,隔绝空气时SiO和NaOH溶液反应(产物之一是硅酸钠)的化学方程式 .
(6)为研究上述反应中钾元素的熔出率(液体中钾元素的质量占全部钾元素质量的百分率)与温度的关系,进行实验(氯化钠与钾长石投料的质量比为2:1),获得如下数据:
①分析数据可以得出,该制备氯化钾的反应是 (填“放热”或“吸热”)反应.
②计算890℃时,氯化钠的平衡转化率 (式量:KAlSi3O8-278 NaAlSi3O8-262,保留3位小数).
(1)上述反应涉及的第三周期元素中,离子半径最小的是
(2)不能用于比较Na与Al金属性相对强弱的事实是
A.最高价氧化物对应水化物的碱性 B.Na和Al的熔点高低
C.单质与H2O反应的难易程度 D.比较同浓度NaCl和AlCl3的pH值
(3)上述元素的最高价氧化物对应水化物中,有一种既能与强酸又能与强碱反应,其原因在于:
(4)钾长石和烧碱在熔融状态下反应可得到两种正盐,向所得的正盐中加入过量稀盐酸,发生反应的离子方程式分别是:
(5)制取粗硅的过程中,SiO是反应中间产物,隔绝空气时SiO和NaOH溶液反应(产物之一是硅酸钠)的化学方程式
(6)为研究上述反应中钾元素的熔出率(液体中钾元素的质量占全部钾元素质量的百分率)与温度的关系,进行实验(氯化钠与钾长石投料的质量比为2:1),获得如下数据:
时间(h) 钾元素 温度 熔出率 |
1.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| 830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 |
| 890℃ | 0.579 | 0.691 | 0.694 | 0.699 | 0.699 |
| 950℃ | 0.669 | 0.714 | 0.714 | 0.714 | 0.714 |
②计算890℃时,氯化钠的平衡转化率
考点:元素周期表的结构及其应用,化学方程式的有关计算,元素周期律的作用,含硅矿物及材料的应用
专题:计算题,元素周期律与元素周期表专题
分析:(1)涉及短周期元素有Na、Al、Si、Cl,离子半径最小的为Al,分子结构对称时为非极性分子;
(2)比较金属性强弱,可根据对应的最高价氧化物的水化物的碱性、金属与酸、水反应的剧烈程度等角度进行判断;
(3)能与强酸又能与强碱反应为氢氧化铝,为两性氢氧化物;
(4)钾长石和烧碱在熔融状态下反应可得到两种正盐,为偏铝酸盐和硅酸盐;
(5)SiO和NaOH溶液反应生成硅酸钠和氢气;
(6)①由表中数据可知,温度越高钾元素的熔出率,说明升高温度,平衡向正反应方向移动;
②根据钾长石和氯化钠的质量、钾的熔出率及钾长石和氯化钠之间的关系式计算氯化钠的转化率.
(2)比较金属性强弱,可根据对应的最高价氧化物的水化物的碱性、金属与酸、水反应的剧烈程度等角度进行判断;
(3)能与强酸又能与强碱反应为氢氧化铝,为两性氢氧化物;
(4)钾长石和烧碱在熔融状态下反应可得到两种正盐,为偏铝酸盐和硅酸盐;
(5)SiO和NaOH溶液反应生成硅酸钠和氢气;
(6)①由表中数据可知,温度越高钾元素的熔出率,说明升高温度,平衡向正反应方向移动;
②根据钾长石和氯化钠的质量、钾的熔出率及钾长石和氯化钠之间的关系式计算氯化钠的转化率.
解答:
解:(1)涉及短周期元素有Na、Al、Si、Cl,阴离子有3个电子层,阳离子有2个电子层,原子序数大的离子半径小,则离子半径最小的为Al,Cl原子与Si原子可以形成的五核分子,其化学键长和键角都相等,分子为正四面体结构,为非极性分子,其电子式为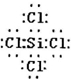 ,
,
故答案为:Al;非极性; ;
;
(2)比较金属性强弱,可根据对应的最高价氧化物的水化物的碱性、金属与酸、水反应的剧烈程度等角度,而熔点与金属性无关,不能用于比较金属性强弱,
故答案为:B;
(3)能与强酸又能与强碱反应为氢氧化铝,为两性氢氧化物,可发生酸式电离和碱式电离,为H++AlO2-+H2O?Al(OH)3?Al3++3OH-,
故答案为:H++AlO2-+H2O?Al(OH)3?Al3++3OH-;
(4)钾长石和烧碱在熔融状态下反应可得到两种正盐,为偏铝酸盐和硅酸盐,均与盐酸反应,离子反应分别为4H++AlO2-=Al3++2H2O、2H++SiO32-=H2SiO3↓,
故答案为:4H++AlO2-=Al3++2H2O;2H++SiO32-=H2SiO3↓;
(5)SiO和NaOH溶液反应生成硅酸钠和氢气,该反应为SiO+2NaOH=Na2SiO3+H2↑,故答案为:SiO+2NaOH=Na2SiO3+H2↑;
(6))①由表中数据可知,温度越高钾元素的熔出率,说明升高温度,平衡向正反应方向移动,则正反应为吸热反应,故答案为:吸热;
②890℃时,当浸出率为3.5时,该反应达到平衡状态,氯化钠与钾长石投料的质量比为2:1,设钾长石的质量为278g,其物质的量为1mol,则氯化钠的质量为556g,当平衡时,钾元素的熔出率为0.669,则钾长石反应的物质的量为0.669mol,
根据NaCl(l)----KAlSi3O8知,氯化钠反应的物质的量也是0.669mol,其转化率为
=0.074(或7.4%),故答案为:0.074(或7.4%).
 ,
,故答案为:Al;非极性;
 ;
;(2)比较金属性强弱,可根据对应的最高价氧化物的水化物的碱性、金属与酸、水反应的剧烈程度等角度,而熔点与金属性无关,不能用于比较金属性强弱,
故答案为:B;
(3)能与强酸又能与强碱反应为氢氧化铝,为两性氢氧化物,可发生酸式电离和碱式电离,为H++AlO2-+H2O?Al(OH)3?Al3++3OH-,
故答案为:H++AlO2-+H2O?Al(OH)3?Al3++3OH-;
(4)钾长石和烧碱在熔融状态下反应可得到两种正盐,为偏铝酸盐和硅酸盐,均与盐酸反应,离子反应分别为4H++AlO2-=Al3++2H2O、2H++SiO32-=H2SiO3↓,
故答案为:4H++AlO2-=Al3++2H2O;2H++SiO32-=H2SiO3↓;
(5)SiO和NaOH溶液反应生成硅酸钠和氢气,该反应为SiO+2NaOH=Na2SiO3+H2↑,故答案为:SiO+2NaOH=Na2SiO3+H2↑;
(6))①由表中数据可知,温度越高钾元素的熔出率,说明升高温度,平衡向正反应方向移动,则正反应为吸热反应,故答案为:吸热;
②890℃时,当浸出率为3.5时,该反应达到平衡状态,氯化钠与钾长石投料的质量比为2:1,设钾长石的质量为278g,其物质的量为1mol,则氯化钠的质量为556g,当平衡时,钾元素的熔出率为0.669,则钾长石反应的物质的量为0.669mol,
根据NaCl(l)----KAlSi3O8知,氯化钠反应的物质的量也是0.669mol,其转化率为
| 0.699mol×58.5g/mol |
| 556g |
点评:本题考查较为综合,涉及元素周期律、离子浓度大小比较,盐水水解的应用等知识,为高频考点,题目设置贴近高考,难度适中,注意相关基础知识的积累,(6)中计算为解答的难点.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
乙醇可通过淀粉等生物质原料发酵制得,属于可再生资源,通过乙醇制取氢气具有良好的应用前景.已知通过乙醇制取氢气有如下两条路线:a.水蒸气催化重整:CH3CH2OH(g)+H2O(g)→4H2(g)+2CO(g)△H=+255.58kJ?mol-1b.部分催化氧化:CH3CH2OH(g)+
O2(g)→3H2(g)+2CO(g)△H=+13.76kJ?mol-1
则下列说法错误的是( )
| 1 |
| 2 |
则下列说法错误的是( )
| A、从原料消耗的角度来看,a路线制氢更有价值 |
| B、从能量消耗的角度来看,b路线制氢更加有利 |
| C、a路线制氢由于要消耗很多能量,所以在实际生产中意义不大 |
| D、降低温度,可提高b路线中乙醇的转化率 |
下列离子方程式表达正确的是( )
| A、向碳酸钠溶液通入少量SO2 2 CO32-+SO2+H2O═2 HCO3-+SO32- |
| B、NaHSO4 溶液和Ba(OH)2溶液反应呈中性 H++SO42-+Ba2++OH-═BaSO4↓+H2O |
| C、NaClO溶液FeCl2溶液混合 2ClO-+Fe2++2H2O═Fe(OH)2↓+2HClO |
| D、NH4Al(SO4)2溶液中加入少量氢氧化钠溶液 NH4++OH-=NH3?H2O |
设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
| A、1mol?L-1的NaClO溶液中所含ClO-的数目为NA | ||
B、常温常压下,1g氧气含O2分子数目为
| ||
| C、1mol Na2O2晶体中含阴、阳离子总数为4NA | ||
| D、将11.2L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA |
下列叙述不正确的是( )
| A、pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c(R2-)+c(HR-)=c(Na+) |
| B、若0.3 mol/L HY溶液与0.3 mol/L NaOH溶液等体积混合后,溶液的pH=9,则:c(OH-)-c(HY)=c(H+)=1×10-9mol/L |
| C、0.2mol?L-1 HCl溶液与等体积0.05 mol?L-1 Ba(OH)2溶液混合后,溶液的pH=1 |
| D、NaHCO3溶液中:c(H+)+c(H2CO3)=c(CO32-)+c(OH-) |
 (1)某课外活动小组同学用如图1装置进行实验,试回答下列问题:
(1)某课外活动小组同学用如图1装置进行实验,试回答下列问题:
