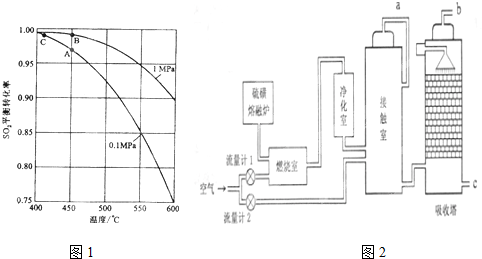
题目内容
图1为实验室制取氨的实验装置.

(1)写出A中所发生反应的化学方程式 .
(2)一位学生用制得的氨,按图2装置进行喷泉实验,烧瓶已充满干燥的氨气,引发喷泉实验的操作是 .
(3)另一学生积极思考产生喷泉的其他方法,设计了图3装置.首先在锥形瓶中分别加入足量的下列物质,反应后产生喷泉的是
A.CaCO3粉末和浓盐酸 B.NH4HCO3溶液与稀NaOH溶液
C.HCl和AgNO3溶液 D.HCl和酚酞溶液.

(1)写出A中所发生反应的化学方程式
(2)一位学生用制得的氨,按图2装置进行喷泉实验,烧瓶已充满干燥的氨气,引发喷泉实验的操作是
(3)另一学生积极思考产生喷泉的其他方法,设计了图3装置.首先在锥形瓶中分别加入足量的下列物质,反应后产生喷泉的是
A.CaCO3粉末和浓盐酸 B.NH4HCO3溶液与稀NaOH溶液
C.HCl和AgNO3溶液 D.HCl和酚酞溶液.
考点:氨的制取和性质
专题:实验题
分析:(1)氯化铵与氢氧化钙反应生成氯化钙、氨气和水;
(2)利用氨气极易溶于水,形成压强差而形成喷泉进行解答;
(3)依据加入的物质能导致锥形瓶中气压变大的原理才能产生喷泉,结合物质的性质分析解答.
(2)利用氨气极易溶于水,形成压强差而形成喷泉进行解答;
(3)依据加入的物质能导致锥形瓶中气压变大的原理才能产生喷泉,结合物质的性质分析解答.
解答:
解:(1)采用的是固+固混合加热制气的方法,故用氯化铵和氢氧化钙固体混合加热制NH3,氯化铵与氢氧化钙反应生成氯化钙、氨气和水,反应的化学方程式为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
(2)氨气极易溶于水,如果打开止水夹,氨气溶于水后烧瓶内压强迅速减小,而形成喷泉,
故答案为:打打开橡皮管的夹子,挤压胶头滴管的胶头,使少量的水进入烧瓶;
(3)CaCO3粉末和浓盐酸反应产生大量二氧化碳,使锥形瓶中压强增大,形成喷泉,故A正确;
B.NH4HCO3溶液与稀NaOH溶液,不产生气体,不能形成喷泉,故B错误;
C.HCl和AgNO3溶液,不产生气体,不能形成喷泉,故C错误;
D.HCl和酚酞溶液,不产生气体,不能形成喷泉,故D错误;
故选:A.
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
(2)氨气极易溶于水,如果打开止水夹,氨气溶于水后烧瓶内压强迅速减小,而形成喷泉,
故答案为:打打开橡皮管的夹子,挤压胶头滴管的胶头,使少量的水进入烧瓶;
(3)CaCO3粉末和浓盐酸反应产生大量二氧化碳,使锥形瓶中压强增大,形成喷泉,故A正确;
B.NH4HCO3溶液与稀NaOH溶液,不产生气体,不能形成喷泉,故B错误;
C.HCl和AgNO3溶液,不产生气体,不能形成喷泉,故C错误;
D.HCl和酚酞溶液,不产生气体,不能形成喷泉,故D错误;
故选:A.
点评:本题考查了氨气的制备和性质,明确反应原理、形成喷泉的原理和操作方法是解答的关键,题目难度不大.

练习册系列答案
相关题目
氮氧化铝(AlON)是一种透明高硬度防弹材料,可以由反应Al2O3+C+N2
2AlON+CO合成,其中是N2氧化剂,下列有关说法正确的是 ( )
| ||
| A、氮氧化铝中氮的化合价是-3 |
| B、氮氧化铝中氧的化合价是-2 |
| C、反应中每生成5.7g AlON 同时生成1.12 L CO |
| D、反应中氧化产物和还原产物的物质的量之比是2:1 |
下列物质中,没有固定沸点的是( )
| A、聚乙烯 | B、氯仿 |
| C、甲苯 | D、异丁烷 |
下列仪器中可以直接用于加热的是( )
| A、量筒 | B、容量瓶 |
| C、坩埚 | D、尾接管 |

 次硫酸氢钠甲醛(NaHSO2?HCHO?2H2O)在印染、医药以及原子能工业中应用广泛,已知次硫酸氢钠甲醛具有强还原性,且在120℃以上发生分解.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
次硫酸氢钠甲醛(NaHSO2?HCHO?2H2O)在印染、医药以及原子能工业中应用广泛,已知次硫酸氢钠甲醛具有强还原性,且在120℃以上发生分解.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下: