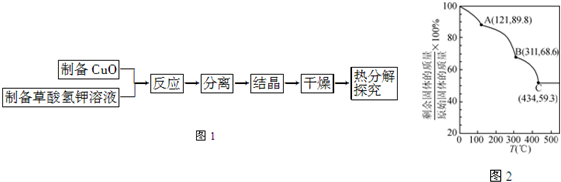
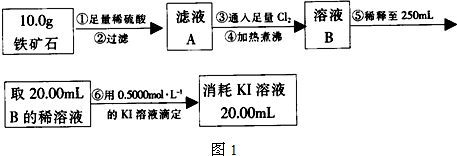
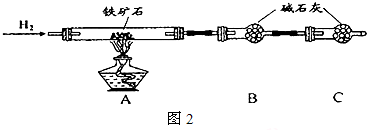
题目内容
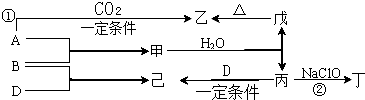
已知:A、B、D为中学常见的单质,只有一种是金属,对应的元素均处在周期表中的短周期;甲、乙、丙、丁、戊、己为短周期元素组成的化合物.其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,分子中不同原子的个数比为1:2,各原子最外层电子都达到稳定结构;乙是一种耐火材料;己是一种无色气体.各物质间的转化关系如图所示(某些条件已略去).请回答:
(1)单质B的组成元素在周期表中的位置是 .
(2)丁的电子式为 .
(3)反应①的化学方程式为 .
(4)丁的燃烧产物对环境无污染.丁-空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液.该电池放电时,通入丁的电极反应式是: ,电池工作一段时间后,电解质溶液的pH将 (填“增大”、“减小”、“不变”).
(5)反应②中,0.5mol NaClO参加反应时,转移1mol 电子,其化学方程式为: .
(6)标准状况下用排水法收集满一烧瓶己(水蒸气不计),塞上带导管的橡皮塞,通过导管向其中缓慢通入氧气,现象是: ,一段时间后,常压下不能再通入氧气,则将烧瓶倒立,导管插入盛水的水槽中,用粘冰水的毛巾冷却烧瓶,即看到烧瓶中出现“喷泉”,“喷泉”结束时,瓶中溶液的物质的量浓度是: .(精确到小数点后三位)
(1)单质B的组成元素在周期表中的位置是
(2)丁的电子式为
(3)反应①的化学方程式为
(4)丁的燃烧产物对环境无污染.丁-空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液.该电池放电时,通入丁的电极反应式是:
(5)反应②中,0.5mol NaClO参加反应时,转移1mol 电子,其化学方程式为:
(6)标准状况下用排水法收集满一烧瓶己(水蒸气不计),塞上带导管的橡皮塞,通过导管向其中缓慢通入氧气,现象是:

考点:位置结构性质的相互关系应用,无机物的推断
专题:元素周期律与元素周期表专题
分析:短周期单质:Na、Mg、Al、C、H2、O2、F2、N2;丙是一种能使湿润的红色石蕊试纸变蓝的无色气体,丙为NH3,丁是一种高能燃料,其组成元素与丙相同,分子中不同原子的个数比为1:2,丁为N2H4,乙是一种耐火材料,耐火材料为Al2O3、MgO;结合图示,甲和水反应生成氨气,甲为Mg3N2,Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑;A为Mg,2Mg+CO2
2MgO+C;B为N2,3Mg+N2
Mg3N2;D为O2,己为NO;4NH3+5O2
4NO+6H2O;A、Mg,B、N2,D、O2,甲、NO,乙、MgO,丙、NH3,丁、N2H4,戊、MgO,己、NO,然后结合物质的性质及化学用语来解答.
| ||
| ||
| ||
解答:
解:(1)单质B为氮气,它的组成元素在周期表中的位置是第二周期第ⅤA族,故答案为:第二周期第ⅤA族;(2)丁为肼,肼是氮原子和氮原子形成一个共价键,剩余价键和氢原子形成共价键,每个N原子有一个孤电子对,其电子式为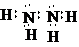 ,
,
故答案为: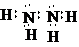 ;
;
(3)反应①为镁和二氧化碳反应生成氧化镁和碳,即2Mg+CO2
2MgO+C,故答案为:2Mg+CO2
2MgO+C;
(4)N2H4的燃烧产物对环境无污染.N2H4-空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液.该电池放电时,通入N2H4的电极反应式是N2H4+4OH--4e-=N2↑+H2O,由于此反应消耗氢氧根,故电池工作一段时间后,pH值将减小,故答案为:N2H4+4OH--4e-=N2↑+H2O;减小;
(5)反应②中,0.5mol NaClO参加反应时,转移1mol 电子,其化学方程式为:2NH3+NaClO=N2H4+NaCl+H2O,故答案为:2NH3+NaClO=N2H4+NaCl+H2O;
(6)一氧化氮遇氧气反应生成红棕色的二氧化氮气体,二氧化氮溶于水生成硝酸和一氧化氮,方程式为:3NO2+H20=2HNO3+NO,故3L水中生成硝酸的物质的量为:
≈0.09mol,故浓度为:0.09mol÷2L=0.045mol/L,故答案为:瓶中无色气体变成红棕色,0.045mol/L.
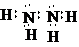 ,
,故答案为:
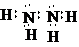 ;
;(3)反应①为镁和二氧化碳反应生成氧化镁和碳,即2Mg+CO2
| ||
| ||
(4)N2H4的燃烧产物对环境无污染.N2H4-空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液.该电池放电时,通入N2H4的电极反应式是N2H4+4OH--4e-=N2↑+H2O,由于此反应消耗氢氧根,故电池工作一段时间后,pH值将减小,故答案为:N2H4+4OH--4e-=N2↑+H2O;减小;
(5)反应②中,0.5mol NaClO参加反应时,转移1mol 电子,其化学方程式为:2NH3+NaClO=N2H4+NaCl+H2O,故答案为:2NH3+NaClO=N2H4+NaCl+H2O;
(6)一氧化氮遇氧气反应生成红棕色的二氧化氮气体,二氧化氮溶于水生成硝酸和一氧化氮,方程式为:3NO2+H20=2HNO3+NO,故3L水中生成硝酸的物质的量为:
| 2L |
| 22.4L/mol |
点评:本题主要考查的考查的是物质的推断以及化学反应方程式的书写以及有关计算,难度较大.

练习册系列答案
相关题目
 如图表示1gO2与1gX气体在相同容积的密闭容器中压强(p)与温度(T)的关系,则X气体可能是( )
如图表示1gO2与1gX气体在相同容积的密闭容器中压强(p)与温度(T)的关系,则X气体可能是( )| A、N2 |
| B、CH4 |
| C、CO2 |
| D、NO |


 用如图所示的收集装置收集氨气时,由于气流略强使得在试管底部形成气旋,导致氨气与空气混合而不能收集到纯氨气.现在有一小团棉花,请问将棉花放在试管那个位置可以阻止气旋?请说明理由.
用如图所示的收集装置收集氨气时,由于气流略强使得在试管底部形成气旋,导致氨气与空气混合而不能收集到纯氨气.现在有一小团棉花,请问将棉花放在试管那个位置可以阻止气旋?请说明理由.