题目内容
13.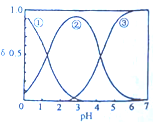 H2C2O4水溶液中H2C2O4、HC2O${\;}_{4}^{-}$和C2O${\;}_{4}^{2-}$三种粒子的分布分数δ随溶液pH的变化如图所示,下列说法不正确的是 ( )
H2C2O4水溶液中H2C2O4、HC2O${\;}_{4}^{-}$和C2O${\;}_{4}^{2-}$三种粒子的分布分数δ随溶液pH的变化如图所示,下列说法不正确的是 ( )| A. | 曲线②代表的粒子是HC2O4- | |
| B. | 0.1mol•L-1NaHC2O4溶液中:c(C2O42-)>c(H2C2O4) | |
| C. | pH=5时,离子浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-) | |
| D. | 一定温度下,往CaC2O4饱和溶液中加入少量CaCl2固体c(C2O42-)减小c(Ca2+)增大 |
分析 A.溶液pH越小,其酸性越强,则H2C2O4的浓度越大,溶液pH越大,溶液中C2O42-的浓度越大,则①代表的是H2C2O4、②代表的是HC2O4-③代表的是C2O42-;
B.由图可知,NaHC2O4溶液显示酸性,阴离子的电离程度大于其水解程度;
C.由图可知,pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(HC2O4-)>c(H2C2O4);
D.加入少量CaCl2固体后平衡逆向移动,c(C2O42-)将减小,溶液中c(Ca2+)增大.
解答 解:A.溶液的pH越大,则溶液中H2C2O4的浓度越小、C2O42-的浓度越大,则曲线②代表的是HC2O4-,故A正确;
B.NaHC2O4溶液呈酸性,则HC2O4-的电离程度大于其水解程度,所以c(H2C2O4)<c(C2O42-),故B正确;
C.根据图象曲线变化可知,pH=5时溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(HC2O4-)>c(H2C2O4),故C错误;
D.一定温度下,往CaC2O4饱和溶液中,存在CaC2O4(s)?C2O42-(aq)+Ca2+(aq)平衡,加入少量CaCl2固体,平衡逆向移动,c(C2O42-)将减小,c(Ca2+)不可抵消,所以c(Ca2+)增大,故D正确;
故选C.
点评 本题考查了弱电解质的电离平衡及其影响,题目难度中等,明确图象曲线变化的含义为解答关键,注意掌握影响电离平衡的因素,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列叙述正确的是( )
①化学反应都遵循质量守恒定律
②化学反应都遵循能量守恒定律
③化学反应都有新物质生成
④化学反应都伴随着能量变化
⑤化学反应都有化学键的破坏和生成.
①化学反应都遵循质量守恒定律
②化学反应都遵循能量守恒定律
③化学反应都有新物质生成
④化学反应都伴随着能量变化
⑤化学反应都有化学键的破坏和生成.
| A. | ① | B. | ①②⑤ | C. | ①②③⑤ | D. | ①②③④⑤ |
5. Cyrneine A对治疗神经系统疾病有着很好的疗效.可用香芹酮经过多步反应合成:下列说法不正确的是( )
Cyrneine A对治疗神经系统疾病有着很好的疗效.可用香芹酮经过多步反应合成:下列说法不正确的是( )
 Cyrneine A对治疗神经系统疾病有着很好的疗效.可用香芹酮经过多步反应合成:下列说法不正确的是( )
Cyrneine A对治疗神经系统疾病有着很好的疗效.可用香芹酮经过多步反应合成:下列说法不正确的是( )| A. | 香芹酮的分子式为C10H14O | |
| B. | Cyrneine A可以发生加成反应、消去反应和氧化反应 | |
| C. | 香芹酮和Cyrneine A均能使酸性KMnO4溶液褪色 | |
| D. | 与香芹酮互为同分异构体,分子中有4种不同化学环境的氢原子的酚类化合物共有3种 |
20.下列关于物质的用途或变化的说法正确的是( )
| A. | 耐火陶瓷可以选用熔点很高的 Al2O3等材料制作 | |
| B. | 含量为 99.9999%的高纯硅用于制作光导纤维 | |
| C. | 高炉炼铁可用铝热反应来迚行冶炼 | |
| D. | “雷雨肥田“是因为 N2不O2在放电条件下生成氮的化合物 |
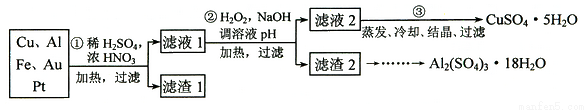
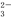 ===2I-+S4O
===2I-+S4O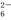 ),到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
),到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
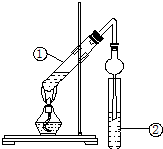 某同学用如图所示实验装置制取乙酸乙酯.在试管①中先加入3mL95%的乙醇,并在摇动下缓缓加入2mL浓硫酸和2mL醋酸.用玻璃棒充分搅拌后将试管固定在铁架台上,在试管②中加入5mL饱和Na2CO3溶液,按图连接装置,用酒精灯对试管①加热,当观察到试管②中有明显现象时停止实验.
某同学用如图所示实验装置制取乙酸乙酯.在试管①中先加入3mL95%的乙醇,并在摇动下缓缓加入2mL浓硫酸和2mL醋酸.用玻璃棒充分搅拌后将试管固定在铁架台上,在试管②中加入5mL饱和Na2CO3溶液,按图连接装置,用酒精灯对试管①加热,当观察到试管②中有明显现象时停止实验.