题目内容
2.制造光导纤维的主要原料是SiO2 (写分子式).分析 二氧化硅具有良好的光学特性,是制备光导纤维主要原料,据此解答.
解答 解:二氧化硅具有良好的光学特性,是制备光导纤维主要原料,二氧化硅的化学式为:SiO2;
故答案为:SiO2.
点评 本题考查了元素化合物的用途,熟悉二氧化硅的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
13.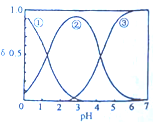 H2C2O4水溶液中H2C2O4、HC2O${\;}_{4}^{-}$和C2O${\;}_{4}^{2-}$三种粒子的分布分数δ随溶液pH的变化如图所示,下列说法不正确的是 ( )
H2C2O4水溶液中H2C2O4、HC2O${\;}_{4}^{-}$和C2O${\;}_{4}^{2-}$三种粒子的分布分数δ随溶液pH的变化如图所示,下列说法不正确的是 ( )
 H2C2O4水溶液中H2C2O4、HC2O${\;}_{4}^{-}$和C2O${\;}_{4}^{2-}$三种粒子的分布分数δ随溶液pH的变化如图所示,下列说法不正确的是 ( )
H2C2O4水溶液中H2C2O4、HC2O${\;}_{4}^{-}$和C2O${\;}_{4}^{2-}$三种粒子的分布分数δ随溶液pH的变化如图所示,下列说法不正确的是 ( )| A. | 曲线②代表的粒子是HC2O4- | |
| B. | 0.1mol•L-1NaHC2O4溶液中:c(C2O42-)>c(H2C2O4) | |
| C. | pH=5时,离子浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-) | |
| D. | 一定温度下,往CaC2O4饱和溶液中加入少量CaCl2固体c(C2O42-)减小c(Ca2+)增大 |
17.现有A、B、C、D、E五种易溶于水的强电解质,它们由如下离子组成(各种离子不重复).
已知:①0.1mol/L A溶液中c(H+)>0.1mol/L;
②B溶液与其它四种溶液反应,均能产生沉淀;
③向C溶液中逐滴加入B溶液,有白色沉淀生成,当B溶液过量时,沉淀完全溶解.
回答下列问题:
(1)写出下列物质的化学式:AH2SO4、BBa(OH)2.
(2)D、E两种物质中必有一种是NH4HCO3,写出将少量该物质的稀溶液滴加到0,1mol/L B溶液中反应的离子方程式Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3H2O+H2O.
(3)用铝粉可除去废水中的NO3-.在pH为10.7左右的溶液中,加入铝粉除去NO3-,同时产生物质的量之比为1﹕1的氨气和氮气,该反应的还原产物是NH3、N2,除去0.1mol NO3-,要消耗铝5.4g,其对应离子方程式为6Al+3NO3-+3OH-=6AlO2-+NH3↑+N2↑.
| 阳离子 | H+、NH4+、Mg2+、Ba2+、Al3+ |
| 阴离子 | OH-、Cl-、HCO3-、NO3-、SO42- |
②B溶液与其它四种溶液反应,均能产生沉淀;
③向C溶液中逐滴加入B溶液,有白色沉淀生成,当B溶液过量时,沉淀完全溶解.
回答下列问题:
(1)写出下列物质的化学式:AH2SO4、BBa(OH)2.
(2)D、E两种物质中必有一种是NH4HCO3,写出将少量该物质的稀溶液滴加到0,1mol/L B溶液中反应的离子方程式Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3H2O+H2O.
(3)用铝粉可除去废水中的NO3-.在pH为10.7左右的溶液中,加入铝粉除去NO3-,同时产生物质的量之比为1﹕1的氨气和氮气,该反应的还原产物是NH3、N2,除去0.1mol NO3-,要消耗铝5.4g,其对应离子方程式为6Al+3NO3-+3OH-=6AlO2-+NH3↑+N2↑.
7.能使酸性高锰酸钾溶液褪色的有机物是( )
| A. | 苯 | B. | 乙烯 | C. | 甲烷 | D. | 聚乙烯 |
14.从自然界中获取金属单质,下列冶炼金属的方法不正确的是( )
| A. | 电解法:MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑ | |
| B. | 热还原法:Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2 | |
| C. | 热分解法:2Al2O3═4Al+3O2↑ | |
| D. | 物理方法:利用密度大的性质水洗矿物提取金 |
9.下列离子方程式书写不正确的是( )
| A. | 锌与稀硫酸反应:Zn+2H+═Zn2++H2↑ | |
| B. | FeCl3溶液中加入氢氧化钠溶液:Fe3++3OH-═Fe(OH)3(胶体) | |
| C. | Ca(NO3)2溶液中滴加少量的Na2CO3溶液:Ca2++CO32-═CaCO3↓ | |
| D. | 常温下氯气与苛性钠溶液反应:Cl2+2OH-═Cl-+ClO-+H2O |
 液和Fe(OH)3胶体的本质区别是后者可以产生丁达尔现象
液和Fe(OH)3胶体的本质区别是后者可以产生丁达尔现象
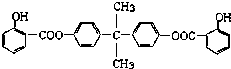
 +n HOCH2CH2OH$\stackrel{一定条件}{→}$
+n HOCH2CH2OH$\stackrel{一定条件}{→}$ +(2n-1)H2O.
+(2n-1)H2O. .
.
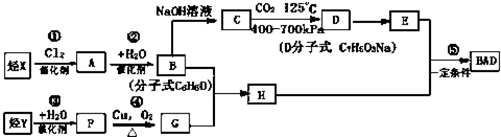
 .
. .F+E
.F+E .
.