题目内容
2.对于3Fe(s)+4H2O(g)$\stackrel{高温}{?}$Fe3O4(s)+4H2(g),若起始投入3mol铁、4mol水汽在体积为0.5L的密闭容器中反应,平衡时氢气的物质的量浓度4mol•L-1.则化学平衡常数为( )| A. | $\frac{1}{54}$ | B. | $\frac{1}{6.75}$ | C. | $\frac{1}{27}$ | D. | 1 |
分析 依据化学平衡三段式列式计算平衡状态的气体浓度,结合平衡常数概念计算得到化学平衡常数,注意固体不写入平衡时计算.
解答 解:平衡时氢气的物质的量浓度4mol•L-1,n=2mol,
3Fe(s)+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4(s)+4H2(g)
起始量(mol) 3 4 0
变化量(mol) 2 2
平衡量(mol) 2 2
平衡时浓度为:c(H2)=$\frac{2mol}{0.5L}$=4mol/L,c(H2O)=$\frac{2mol}{0.5L}$=4mol/L,
平衡常数K=$\frac{{c}^{4}({H}_{2})}{{c}^{4}({H}_{2}O)}$=$\frac{{4}^{4}}{{4}^{4}}$=1,
故选D.
点评 本题考查了化学平衡常数的计算应用,题目难度不大,明确化学平衡常数的概念及表达式为解答关键,注意固体和纯液体不能写入平衡常数表达式,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
2.作为新世纪的年轻公民都应具有一定的化学科学素养,否则,在工作和生活中就可能闹笑话.下列有关媒体的报道与化学知识不相违背的是( )
| A. | 某饮料公司的广告语为“本公司生产的饮料不含任何化学物质” | |
| B. | 该科研人员发明了一种特殊催化剂,可以使水变为汽油 | |
| C. | 有关部门利用明矾对饮用水进行消毒杀菌,从而解决了灾民饮水难的问题 | |
| D. | 该科研机构发明了一种用植物秸秆生产乙醇的新工艺 |
3.室温下向10mL氨水溶液中加水稀释后,下列各量增大的有( )(下同),减小的有( )
| A. | 溶液中c(NH4+)离子浓度 | B. | 氨水的电离程度 | ||
| C. | 水的离子积常数 | D. | c(H+)/c(NH3•H2O) |
20.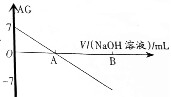 若用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].室温下实验室中用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1的醋酸,滴定过程如图所示,下列叙述正确的是( )
若用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].室温下实验室中用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1的醋酸,滴定过程如图所示,下列叙述正确的是( )
 若用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].室温下实验室中用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1的醋酸,滴定过程如图所示,下列叙述正确的是( )
若用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].室温下实验室中用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1的醋酸,滴定过程如图所示,下列叙述正确的是( )| A. | 室温下,醋酸的电离常数约为10-6 | |
| B. | A点时加入氢氧化钠溶液的体积为20.00mL | |
| C. | 若B点为40mL,所得溶液中:c(OH-)=c(CH3COO-)+c(H+)+2c(CH3COOH) | |
| D. | 反应过程中一定存在:0.01mol•L-1+c(OH-)=c(Na+)+c(H+)+c(CH3COOH) |
7.两种气态烃组成的混合物6.72L(标准状况),完全燃烧生成0.48molCO2和10.8g水,则该混合烃中( )
| A. | 一定不存在乙烯 | B. | 一定不存在甲烷 | C. | 一定存在甲烷 | D. | 一定存在乙烯 |
7.某温度下,可逆反应mA(g)+nB(g)??pC(g)的平衡常数为K,下列对K的说法正确的是( )
| A. | K值越大,表明该反应越有利于C的生成 | |
| B. | 若缩小反应器的容积,能使平衡正向移动,则K增大 | |
| C. | 温度越高,K一定越大 | |
| D. | 如果m+n=p,则K=1 |
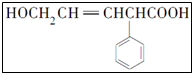 写出该有机物结构中含氧官能团的名称羟基、羧基.
写出该有机物结构中含氧官能团的名称羟基、羧基.
 ;
; .
.