题目内容
20.“Cl化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2 (g)+3H2(g)?CH3OH g)+H2O(g)△H=-49.0kJ/mol.相关数据如下:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和1mol H2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收 a kJ |
②若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是0.03mol/(L•S)
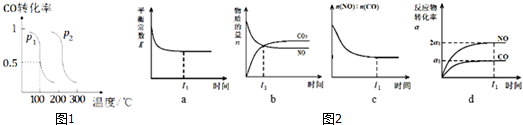
(2)压强为p1时,向体积为1L的密闭容器中充入b mol CO 和2b mol H2,发生反应CO (g)+2H2(g)?CH3OH(g).平衡时CO的转化率与温度、压强的关系如图1所示.请回答:①该反应属于放(填“吸”或“放”)热反应;p1 <p2(填“>”、“<”或“=”)
②100℃时,该反应的平衡常数K=$\frac{1}{{b}^{2}}$(用含b的代数式表示).
(3)一定条件下,治理汽车尾气的反应是2NO(g)+2CO(g)?2CO2(g)+N2(g)△H<0.在恒温恒容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应.下列图象正确且能说明反应在进行到t1时刻一定达到平衡状态的是cd(选填字母).
分析 (1)①应用恒温恒容条件下的等效平衡知识来解决;甲、乙是等效平衡,则甲中放出的热量与乙中吸收的热量之和为49.0kJ;
②平衡时能量变化放出29.4kJ,求平衡时各组分的浓度,然后求平均反应速率;
(2))①根椐温度的变化来判断反应热,依据反应是气体体积减小的反应,铜温度下增大压强平衡正向进行;
②100°C时一氧化碳的转化率为50%,结合平衡三段式列式计算平衡浓度结合平衡常数概念计算得到;
(3)可逆反应达到平衡状态时,正逆反应速率相等,各组分浓度不再变化,据此进行判断.
解答 解:(1)①应用恒温恒容条件下的乙的投料量极端转化为甲相当于投1mol CO2(g)和3mol H2(g),所以两者是等效平衡,所以c1=c2,甲、乙是等效平衡,则甲中放出的热量与乙中吸收的热量之和为49.0kJ,则a=49.0kJ-29.4kJ=19.6kJ,
故答案为:=;19.6;
②平衡时能量变化放出29.4kJ,所以反应二氧化碳的物质的量为$\frac{29.4KJ}{49.0KJ}$=0.6mol,所以,然后求平均反应速率v=$\frac{\frac{0.6mol}{2L}}{10s}$=0.03mol/(L•s),
故答案为:0.03;
(2)①温度升高,一氧化碳的转化率下降,平衡正向移动,所以正反应是放热反应,图象分析可知相同温度下P2压强下一氧化碳转化率大于P1压强下一氧化碳转化率,反应是气体体积减小的反应,压强增大平衡正向进行,所以P1<P2,
故答案为:放;<;
②向VL恒容密闭容器中充入a mol CO与2a mol H2,100°C时一氧化碳的转化率为50%,
CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L):b 2b 0
变化量(mol/L):0.5b b 0.5b
平衡量(mol/L) 0.5b b 0.5b
平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$=$\frac{0.5b}{0.5b×{b}^{2}}$=$\frac{1}{{b}^{2}}$,
故答案为:$\frac{1}{{b}^{2}}$;
(3)当反应前后改变的物理量不变时,该可逆反应达到平衡状态,
a中为平衡常数,平衡常数与温度有关,温度不变,则平衡常数始终不变,所以平衡常数不能判断是否达到平衡状态,故a错误;
b为物质的量随时间的变化,一氧化氮与二氧化碳浓度相等时,各组分浓度仍然继续变化,说明没有达到平衡状态,故b错误;
c为CO质量分数随时间变化,反应恰好总质量不变,则反应过程中一氧化氮与一氧化碳的物质的量之比会发生变化,当达到平衡状态时,一氧化氮与一氧化碳的物质的量之比不再变化,故c正确;
d、反应物的转化率不变,说明达平衡状态,故d正确;
故答案为:cd.
点评 本题考查了热化学方程式和盖斯定律的计算应用,化学平衡影响因素的分析判断,平衡移动原理分析应用,题目难度中等.

| A. | 该反应是放热反应,降低温度将缩短反应达到平衡的时间 | |
| B. | 增大反应体系的压强,反应速率一定增大 | |
| C. | 进入接触室的SO2和空气必须进行净化,且该反应不需要在高压下进行 | |
| D. | 催化剂V2O5能增大该反应的正反应速率而不改变逆反应速率 |
| A. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.6mol H2SO4的稀硫酸与含1mol NaOH的稀溶液混合,放出的热量等于57.3 kJ | |
| B. | 已知正丁烷(g)→异丁烷(g)△H<0,则正丁烷比异丁烷稳定 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
| A. | 增加C,B的平衡转化率不变 | |
| B. | 此时,B的平衡转化率是35% | |
| C. | 增大该体系的压强,平衡向右移动,化学平衡常数增大 | |
| D. | 该反应的化学平衡常数表达式是K=$\frac{{c}^{4}(C){c}^{2}(D)}{{c}^{3}(A){c}^{2}(B)}$ |