题目内容
纳米是长度单位,l nm=10 -9m,当物质的颗粒达到纳米级时,会具有一些特殊的性质.如由铜制成“纳米铜”具有非常强的化学活性,在空气中可以燃烧.下列关于“纳米铜“的叙述正确的是( )
| A、“纳米铜”比铜片的金属性强 |
| B、“纳米铜”比铜片更易失去电子 |
| C、“纳米铜“比铜片的氧化性强 |
| D、“纳米铜”的还原性与铜片相同 |
考点:纳米材料,铜金属及其重要化合物的主要性质
专题:
分析:纳米铜之所以具有较强的化学活性是由于纳米材料的颗粒较小,表面积较大,与氧气的接触面积较大而能在空气中的燃烧,而铜的金属性、活泼性等没有发生变化.
解答:
解:A.金属性属于元素的性质,都为铜元素,金属性相同,故A错误;
B.纳米铜之所以具有较强的化学活性是由于纳米材料的颗粒较小,表面积较大,与氧气的接触面积较大而能在空气中的燃烧,都是不活泼金属,失电子能力相同,故B错误;
C.铜为金属,在反应中只能失去电子,只有还原性,不具有氧化性,故C错误.
D.在相同条件下,纳米铜和铜片的还原性是相同的,物质的性质是决定化学反应速率主要因素,故D正确;
故选D.
B.纳米铜之所以具有较强的化学活性是由于纳米材料的颗粒较小,表面积较大,与氧气的接触面积较大而能在空气中的燃烧,都是不活泼金属,失电子能力相同,故B错误;
C.铜为金属,在反应中只能失去电子,只有还原性,不具有氧化性,故C错误.
D.在相同条件下,纳米铜和铜片的还原性是相同的,物质的性质是决定化学反应速率主要因素,故D正确;
故选D.
点评:本题为信息给予题,题目难度中等,本题注意影响化学反应速率的因素,易错点为B、C,注意物质的本身的性质与外界因素影响的不同.

练习册系列答案
相关题目
在密闭容器中,反应xA(g)?yB(g)达到平衡后,保持温度不变,将容器体积增加为原来的二倍,当达到新的平衡时,B的浓度是原来的70%,则( )
| A、平衡向正反应方向移动了 |
| B、物质A的转化率减少了 |
| C、物质B的质量分数减少了 |
| D、x>y |
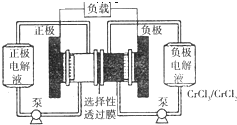 铁路氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为Fe3++Cr2+
铁路氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为Fe3++Cr2+ | 放电 |
| 充电 |
| A、电池充电时,阴极的电极反应式为Cr3++e-=Cr2+ |
| B、电池放电时,负极的电极反应式为Fe2+-e-=Fe3+ |
| C、电池放电时,Cl-从负极穿过选择性透过膜移向正极 |
| D、电池放电时,电路中每通过0.1mol电子,Fe3+浓度降低0.1mol?L-1 |
在溶液导电性实验装置里,分别注入同体积同浓度的H2SO4溶液与Ba(OH)2溶液,灯光明暗程度相似.如果把这两种溶液混合后再实验,则( )
| A、灯光明暗程度不变 |
| B、灯光变暗或不亮 |
| C、灯光变亮 |
| D、无法判断 |
下列物质属于电解质的是( )
| A、NaCl溶液 |
| B、熔融BaDO4 |
| C、NH3 |
| D、蔗糖 |
下列事实与胶体性质无关的是( )
| A、在豆浆里加入盐卤做豆腐 |
| B、盐碱地保肥能力差 |
| C、一束平行光线照射蛋白质溶液,从侧面可以看到一束光亮的通路 |
| D、氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀 |
一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4?H2C2O4?2H2O.若用0.1000mol?L-1的NaOH溶液中和相同质量的KHC2O4?H2C2O4?2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol?L-1)为( )
| A、0.008 889 |
| B、0.080 0 |
| C、0.120 0 |
| D、0.240 0 |
几难溶物质的有关数值如表所示:下列关于含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法正确的是( )
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-36 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | ≥3 |
| A、向该混合溶液中逐滴加入NaOH溶液,最先看到蓝色沉淀 |
| B、该溶液中c(SO42-):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5:4 |
| C、当pH=10时,溶液中c(Fe2+):c(Fe3+)=2×1020:1 |
| D、向该溶液中加入适量氨,调节pH到9.6后过滤,将所得的沉淀灼烧,可得等物质的量的CuO、FeO、Fe2O3三种固体的混合物 |
下列说法正确的是( )
| A、准状况下,1 mol任何物质体积均为22.4L |
| B、2g H2含1mol H |
| C、氧气的摩尔质量是32 g/mol |
| D、3.01×1023个SO2分子的质量为64g |