题目内容
2.“类推”是学习化学过程中常用的思维方法.现有以下类推结果,其中错误的是( )①酸碱中和反应生成盐和水,所以生成盐和水反应一定是中和反应;
②氧化物中含有氧元素,所以含有氧元素的化合物一定是氧化物;
③金属铝与盐酸反应生成AlCl3和H2,所以金属铁与盐酸反应生成FeCl3和H2;
④浓盐酸试剂瓶敞口久置后变稀且质量减轻,所以浓硫酸敞口久置也变稀且质量减轻.
| A. | ① | B. | ①③ | C. | ①②③④ | D. | ①②④ |
分析 ①中和反应是指酸和碱作用生成盐和水的反应,判断中和反应时一要看反应物是否是酸和碱,二是看生成物是否是盐和水,二者缺一不可;
②氧化物是只含有两种元素且其中一种元素是氧元素的化合物;
③根据金属的化学性质进行分析判断;
④根据浓盐酸具有挥发性、浓硫酸具有吸水性.
解答 解:①酸碱中和反应生成盐和水,但生成盐和水的反应不一定是中和反应,如CO2+2NaOH═Na2CO3+H2O,故错误;
②氧化物是只含有两种元素且其中一种元素是氧元素的化合物,氧化物含有氧元素,但含氧元素的化合物不一定都是氧化物,如Ca(OH)2等,故错误;
③金属铝与盐酸反应生成AlCl3和H2,金属铁也能与盐酸反应,生成FeCl2和H2,故错误;
④浓盐酸具有挥发性,浓盐酸试剂瓶敞口久置后变稀且质量减轻;浓硫酸具有吸水性,敞口久置也变稀但质量变大,故错误.
故①②③④类推均错误.
故选C.
点评 本题综合考查物质的组成、性质,为高频考点,侧重于学生的分析能力的考查,注意把握常见元素化合物的性质,难度不大,学习中注意相关知识的积累.

练习册系列答案
相关题目
15.已知某溶液中含有Na+、Ba2+、Fe3+三种阳离子,那么溶液中的阴离子可能是( )
| A. | SO42- | B. | Cl- | C. | OH- | D. | NO3- |
15.NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 钠在空气中燃烧可生成多种氧化物.23g钠充分燃烧时转移电子数为1NA | |
| B. | 32g甲醇中存在的共价键总数是6 NA | |
| C. | 1L 0.1mol•L-1的NaHCO3溶液中氧原子数为0.3NA | |
| D. | 235g核素92235U中的中子数为92 NA |
10.室温下,将amol钠和amol铝一同放入mg水(足量)中,所得溶液的密度为dg/mL,下列说法正确的是( )
| A. | 该溶液的物质的量浓度:$\frac{ad}{46a+m}$mol/L | |
| B. | 所得气体体积为44.8aL | |
| C. | 向溶液中通入过量CO2,未见白色沉淀 | |
| D. | 该溶液的质量分数:$\frac{8200a}{46a+m}$% |
17.有一真空瓶质量为m1,充满氨气后总质量为m2.在相同状况下若改为充满某气体A时总质量为m3,则A的相对分子质量是( )
| A. | $\frac{17{m}_{2}}{{m}_{1}}$ | B. | $\frac{17{m}_{3}}{{m}_{1}}$ | ||
| C. | $\frac{17({m}_{3}-{m}_{1})}{{m}_{2}-{m}_{1}}$ | D. | $\frac{17({m}_{2}-{m}_{1})}{{m}_{3}-{m}_{1}}$ |
14.下列离子方程式的书写正确的是( )
| A. | 少量NaHCO3溶液与Ca(OH)2溶液反应:OH-+HCO3-=CO32-+H2O | |
| B. | 向AlCl3溶液中加入过量NaOH溶液:Al3++3OH-=Al(OH)3↓ | |
| C. | 实验室用NH4Cl和Ca(OH)2共热制取NH3:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | CO2和足量澄清石灰水反应:CO2+Ca2++2OH-=CaCO3↓+H2O |
11.用NA表示阿伏加德罗常数的值,下列叙述中确的是( )
| A. | 7gCnH2n中含有的氢原子数目为NA | |
| B. | 标准状况下,22.4LCHCl3中含原子总数等于5NA | |
| C. | 1molC5H12分子中所含单键数为15NA | |
| D. | 标准状况下,11.2L已烷中含3mol碳原子 |
下列各组物质按右图所示转化关系每一步都能一步实现的是
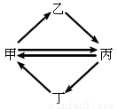
甲 | 乙 | 丙 | 丁 | |
A. | FeCl3 | FeCl2 | Fe2O3 | Fe(OH)3 |
B. | NO | HNO3 | NO2 | NH3 |
C. | Cu | CuO | CuSO4 | CuCl2 |
D. | Si | Na2SiO3 | SiO2 | SiF4 |
 ,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3).C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.
,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3).C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.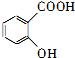 .
. .
. 为主要原料制备
为主要原料制备 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).