题目内容
14.下列属于放热反应的是( )| A. | 浓硫酸稀释 | B. | 氢气还原氧化铜 | ||
| C. | 氢氧化钡与氯化铵固体混合搅拌 | D. | 铝和稀硫酸反应 |
分析 根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱),C或氢气做还原剂时的反应.
解答 解:A.浓硫酸的稀释是物理变化,故A错误;
B.氢气还原氧化铜的反应是吸热反应,故B错误;
C.氢氧化钡晶体与氯化铵晶体的反应是吸热反应,故C错误;
D.铝和稀硫酸反应是放热反应,故D正确;
故选D.
点评 本题考查放热反应,抓住中学化学中常见的吸热或放热的反应是解题的关键,对于特殊过程中的热量变化的要熟练记忆来解答此类习题,题目难度不大.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
5.有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Ba2+、Cl-、CO32-、SO42-.现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体0.68g;②第二份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.根据上述实验,以下推测正确的是( )
| A. | 一定不存在Ba2+,NH4+可能存在 | B. | CO32-一定存在 | ||
| C. | Na+一定存在 | D. | 一定不存在Cl- |
2.一次区分CH3COOH、CH3CH2OH、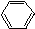 、
、 ,四种物质的是( )
,四种物质的是( )
 、
、 ,四种物质的是( )
,四种物质的是( )| A. | 溴水 | B. | Na2CO3溶液 | C. | 水 | D. | NaHSO4溶液 |
9.如图是关于N2+3H2?2NH3(正反应为放热反应)的速率一时问图象,则t1时刻使平衡发生移动的原因是( )

| A. | 升高温度,同时增大压强 | |
| B. | 降低温度.同时减小压强 | |
| C. | 增大反应物的浓度,同时使用适宜的催化剂 | |
| D. | 增大反应物的浓度,同时减小生成物的浓度 |
19.对下列事实的解释错误的是( )
| A. | 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 | |
| B. | 浓硝酸在光照条件下颜色变黄,说明浓硝酸不稳定 | |
| C. | 常温下浓硫酸、浓硝酸可以用铝罐储存,说明浓硫酸、浓硝酸与铝不反应 | |
| D. | 反应CuSO4+H2S═CuS↓+H2SO4说明硫化铜既不溶于水,也不溶于稀硫酸 |
6.一定条件下,在体积为10L的固定容器中发生的反应:N2+3H2?2NH3,反应过程如图所示,下列说法正确的是( )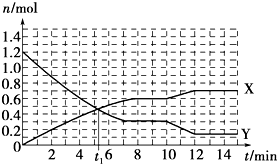

| A. | t1min时正、逆反应速率相等 | |
| B. | X曲线表示NH3的物质的量随时间变化的关系 | |
| C. | 0~8 min,H2的平均反应速率v(H2)=0.75 mol•L-1•min-1 | |
| D. | 10~12 min,N2的平均反应速率为v(N2)=0.25mol•L-1•min-1 |
3.有四种物质的溶液:①Ba(OH)2、②Na2SO4、③HNO3、④CuCl2,不用其他试剂就可将它们逐一鉴别出来,其鉴别顺序是( )
| A. | ④①②③ | B. | ①③④② | C. | ④③②① | D. | ①④②③ |
4.下列各组物质在通常条件下既可由置换反应得到,又可由复分解反应制得的是( )
| A. | Na2O | B. | NaOH | C. | NaHCO3 | D. | Na2O2 |