题目内容
6.一定条件下,在体积为10L的固定容器中发生的反应:N2+3H2?2NH3,反应过程如图所示,下列说法正确的是( )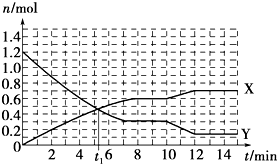
| A. | t1min时正、逆反应速率相等 | |
| B. | X曲线表示NH3的物质的量随时间变化的关系 | |
| C. | 0~8 min,H2的平均反应速率v(H2)=0.75 mol•L-1•min-1 | |
| D. | 10~12 min,N2的平均反应速率为v(N2)=0.25mol•L-1•min-1 |
分析 根据图知,随着反应的进行,X的物质的量增大、Y的物质的量减少,反应达到平衡状态时,X、Y的物质的量变化量分别为:△n(X)=(0.6-0)mol=0.6mol,△n(Y)=(1.2-0.3)mol=0.9mol,则X、Y的物质的量变化量之比等于其计量数之比=0.6mol:0.9mol=2:3,则X是NH3、Y是H2,
A.可逆反应达到平衡状态时正逆反应速率相等,没有达到平衡状态时正逆反应速率不等;
B.根据以上分析知,X表示NH3;
C.0~8 min,H2的平均反应速率v(H2)=$\frac{\frac{0.9mol}{10L}}{8min}$;
D.10~12 min,NH3的平均反应速率v(NH3)=$\frac{\frac{(0.7-0.6)mol}{10L}}{(12-10)min}$=0.005mol•L-1•min-1,再根据同一可逆反应中同一时间段内各物质的反应速率之比等于其计量数之比计算氮气反应速率.
解答 解:根据图知,随着反应的进行,X的物质的量增大、Y的物质的量减少,反应达到平衡状态时,X、Y的物质的量变化量分别为:△n(X)=(0.6-0)mol=0.6mol,△n(Y)=(1.2-0.3)mol=0.9mol,则X、Y的物质的量变化量之比等于其计量数之比=0.6mol:0.9mol=2:3,则X是NH3、Y是H2,
A.可逆反应达到平衡状态时正逆反应速率相等,没有达到平衡状态时正逆反应速率不等,根据图知,t1min时该反应没有达到平衡状态,所以正逆反应速率不等,故A错误;
B.根据以上分析知,X曲线表示NH3的物质的量随时间变化的关系,故B正确;
C.0~8 min,H2的平均反应速率v(H2)=$\frac{\frac{0.9mol}{10L}}{8min}$=0.01125mol•L-1•min-1,故C错误;
D.10~12 min,NH3的平均反应速率v(NH3)=$\frac{\frac{(0.7-0.6)mol}{10L}}{(12-10)min}$=0.005mol•L-1•min-1,再根据同一可逆反应中同一时间段内各物质的反应速率之比等于其计量数之比计算氮气反应速率为0.0025mol•L-1•min-1,故D错误;
故选B.
点评 本题考查图象分析,为高频考点,侧重考查学生分析计算能力及识图能力,易错选项是A.注意:各物质的物质的量相等状态不一定是化学平衡状态,为易错点.

| A. | 氯化钠溶液能导电,所以氯化钠溶液是电解质 | |
| B. | 氯化钠固体不导电,所以氯化钠不是电解质 | |
| C. | 氯化氢溶液能导电,所以氯化氢是电解质 | |
| D. | 氯气溶于水能导电,所以氯气是电解质 |
| A. | 浓硫酸稀释 | B. | 氢气还原氧化铜 | ||
| C. | 氢氧化钡与氯化铵固体混合搅拌 | D. | 铝和稀硫酸反应 |
| A. | C2H5OH | B. | H2O | C. | CH3COOH | D. | C6H6 |
| A. |  倾倒液体 | B. |  取粉末状固体药品 | ||
| C. |  过滤 | D. |  浓硫酸的稀释 |
 室温下向10mL 0.1mol/L NaOH 溶液中加入0.1mol/L 的一元酸HA 溶液pH 的变化曲线如图所示.下列说法正确的是( )
室温下向10mL 0.1mol/L NaOH 溶液中加入0.1mol/L 的一元酸HA 溶液pH 的变化曲线如图所示.下列说法正确的是( )| A. | a 点所示溶液中c(A-)+c(HA)=0.1mol/L | |
| B. | a、b 两点所示溶液中水的电离程度不同 | |
| C. | pH=7 时,c(Na+)=c(A-)+c(HA) | |
| D. | b 点所示溶液中c(HA)>c(A-) |
| A. | 化学键是一种静电引力 | |
| B. | 化学键可以使离子结合,也可以使原子结合 | |
| C. | 只要有旧健的断裂就一定是化学反应 | |
| D. | 氢键是一种化学键 |
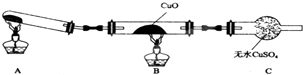 某校研究性学习小组的同学学习完氮的有关物质的性质之后,对氮元素的氢化物NH3性质的探究.
某校研究性学习小组的同学学习完氮的有关物质的性质之后,对氮元素的氢化物NH3性质的探究.
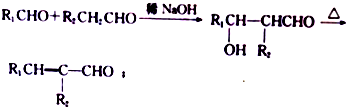

 .
. +(2n-1)H2O.
+(2n-1)H2O. (写出其中一种结构简式).
(写出其中一种结构简式). )的合成路线示意图.
)的合成路线示意图.